Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Термохимические измененияБиблиотека / Основные задачи термохимии. Использование калориметрических методов для определения теплот растворения солей / Библиотека / Основные задачи термохимии. Использование калориметрических методов для определения теплот растворения солей / Термохимические изменения Термохимические изменения
Ввиду разнообразия в поведении растворы классифицируют в соответствии с их термодинамическими свойствами. С этой точки зрения различают идеальные и неидеальные растворы. Для большинства физико-химических расчетов необходимо знать теплоемкости веществ, участвующих в процессе, тепловые эффекты процессов растворения, фазовых превращений и химических реакций. Эти величины можно измерить экспериментально. При температурах, близких к комнатной (20-50оС), широко применяется калориметрический метод.
При калориметрических опытах величина и знак теплового эффекта Q процесса определяются по изменению температуры калориметра Dt:
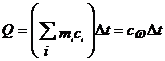 (1)
(1)
где mi – масса исследуемого вещества, калориметра и вспомогательных устройств (мешалки, ампулы, термометра); c – удельные теплоемкости исследуемого вещества, калориметра и вспомогательных устройств; сw - суммарная теплоемкость калориметрической системы. Уравнение (1) может быть записано
Q=(K+m1c1)Dt
где K – константа калориметра, то есть теплоемкость частей калориметра и вспомогательных устройств, участвующих в теплообмене, Дж/К; с1 – теплоемкость содержимого калориметра; Dt – изменение температуры процесса, протекающего в условиях отсутствия теплообмена калориметра с окружающей средой.
Калориметр с изотермической оболочкой (диатермический) позволяет учесть теплообмен его с окружающей средой, что дает возможность вычислить изменение температуры Dt, соответствующее опыту без теплообмена.
Теплоемкость систему С называют производную dQ/dT. Теплоемкость газов и жидкостей зависит от температуры, а теплоемкость твердых веществ при средних и высоких температурах практически от нее не зависит. При расчетах часто использую теплоемкость.
Средней теплоемкостью однородного тела называют отношение подведенной теплоты к повышению температуры:
![]()
Средняя теплоемкость ![]() зависит от интервала температур (Т2 – Т1). Зависимость между истинной и средней теплоемкостями выражается уравнением
зависит от интервала температур (Т2 – Т1). Зависимость между истинной и средней теплоемкостями выражается уравнением
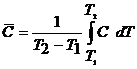
При DТ£5о даже на совершенных калориметрах (при измерении с точностью 0,05%) не удается установить различия между истинной и средней теплоемкостью. Поэтому теплоемкость, определенную в результате изменения температуры калориметра на 2-3о, принимают за истинную и относят ее к температуре (Т2+Т1)/2. Теплоемкость однородного тела зависит от его массы:
С=сm или ![]() ,
,
где ![]() удельная теплоемкость вещества; m – масса вещества. Если масса равна молярной или атомной массе, то теплоемкость будет соответственно молярной или атомной. Если во время опыта давление в калориметрической системе остается постоянным (в калориметрах открытого типа оно равно атмосферному), то тепловой эффект процесса при постоянном давлении будет Qр, а теплоемкость Ср. При термохимических изменениях процессам, сопровождающимся выделением теплоты (экзотермическим процессам), приписывается положительный знак. При выделении системной теплоты ее энтальпия убывает. Откуда Qр=-DH. Если в уравнениях тепловой эффект обозначен Q или q, то следует применять термохимическую систему знаков.
удельная теплоемкость вещества; m – масса вещества. Если масса равна молярной или атомной массе, то теплоемкость будет соответственно молярной или атомной. Если во время опыта давление в калориметрической системе остается постоянным (в калориметрах открытого типа оно равно атмосферному), то тепловой эффект процесса при постоянном давлении будет Qр, а теплоемкость Ср. При термохимических изменениях процессам, сопровождающимся выделением теплоты (экзотермическим процессам), приписывается положительный знак. При выделении системной теплоты ее энтальпия убывает. Откуда Qр=-DH. Если в уравнениях тепловой эффект обозначен Q или q, то следует применять термохимическую систему знаков.
Смотрите также
Физическая связь
...
Газификация углей
В связи со сложной экологической ситуацией
современная технология ищет новых
решений химических,
энергетических проблем, проблем добычи природных ископаемых.
...
Свойства кальция
...


