Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Молекулярные орбитали этиленаОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Молекулярные орбитали этилена Молекулярные орбитали этилена
Орбитали молекулы этилена можно построить из двух фрагментов СН2, имеющих ангулярную форму. Орбитали этих фрагментов в свою очередь строятся из орбиталей атома углерода и групповых орбиталей ансамбля Н2, полученного путем удаления двух атомов водорода их тетраэдрического ансамбля Н4:
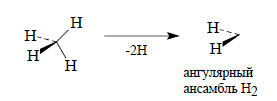
Этот ансамбль имеет всего две орбитали: симметричную ϕ1 и антисимметричную ϕ2:

Диаграмма орбитального взаимодействия для ангулярного фрагмента СН2 приведена на рис. 2.23.
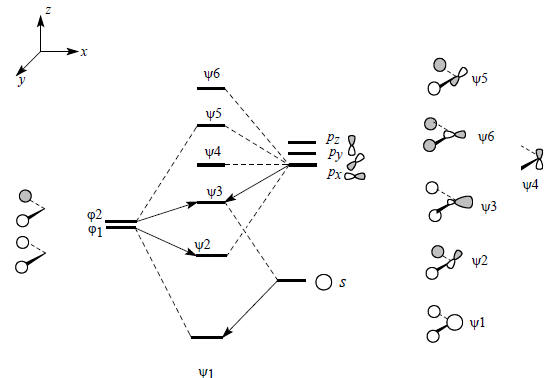 Рис. 2.23. Диаграмма орбитального взаимодействия для ангулярного фрагмента СН2.
Рис. 2.23. Диаграмма орбитального взаимодействия для ангулярного фрагмента СН2.
Орбитали ψ1, ψ2, ψ5 и ψ6 образуются путем следующих парных взаимодействий:
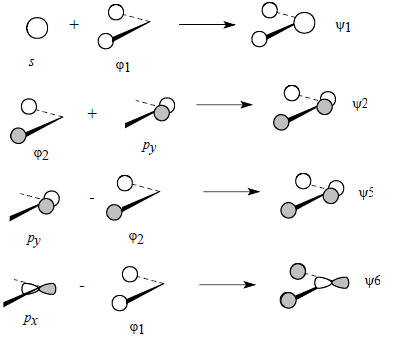
Орбиталь pz атома углерода не возмущается, поскольку она ортогональна как орбитали ϕ1, так и орбитали ϕ2, следовательно, во фрагменте СН2 на атоме углерода будет существовать несвязывающая pz -орбиталь.
Орбиталь pz атома углерода не возмущается, поскольку она ортогональна как орбитали ϕ1, так и орбитали ϕ2, следовательно, во фрагменте СН2 на атоме углерода будет существовать несвязывающая pz -орбиталь
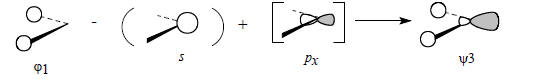
Большая доля гибридной атомной орбитали, центрированной на атоме углерода, направлена в сторону от атомов водорода, что и определяет общий несвязывающий характер орбитали ψ3.Теперь мы можем построить молекулярные орбитали молекулы этилена, объединив два ангулярных фрагмента СН2, как показано на рис. 2.24 (приведены лишь четыре из шести орбиталей фрагмента СН2).
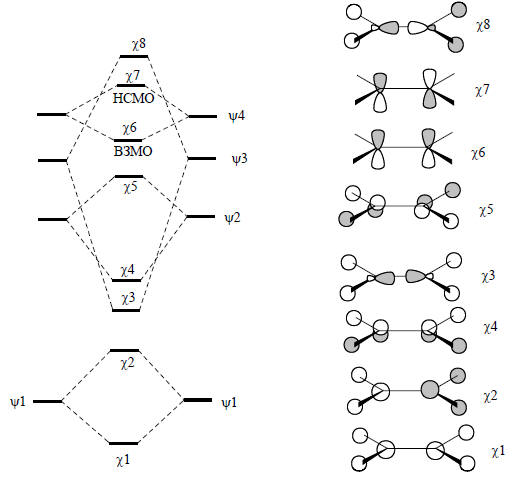 Рис. 2.24. Образование МО этилена из ангулярных фрагментов СН2.
Рис. 2.24. Образование МО этилена из ангулярных фрагментов СН2.
Этилен имеет 12 валентных электронов, поэтому ВЗМО будет являться шестая орбиталь χ6, а НСМО - седьмая орбиталь χ7. Поскольку, как и в случае этана (рис. 2.22), расщепление уровней фрагментов СН2 наибольшее для несвязывающих уровней ψ7, так как перекрывание этих орбиталей очень хорошее из-за их соответствующей пространственной направленности, граничными орбиталями этилена будут орбитали π-симметрии. Орбитали χ6 и χ7 связывают только атомы углерода. Орбиталь χ4 также относится к π-типу, но она лежит ниже по энергии, так как связывает не только два атома углерода, но и атомы водорода с атомами углерода. Следовательно, эта орбиталь не будет граничной орбиталью, и химические свойства в первую очередь будут определяться орбиталями χ6 и χ7 .
Смотрите также
Исследование способов введения белковых компонентов в синтетический полиизопрен
...
Производство сульфата магния фармакопейного
Химический завод им. Л.Я. Карпова основан в 1868 г. и по праву считается старейшим предприятием химической индустрии России. Благодаря ему
Россия смогла отказаться от ввоза дорогост ...


