Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Молекулярные орбитали этанаОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Молекулярные орбитали этана Молекулярные орбитали этана
Молекулярные орбитали этана С2Н6 можно легко построить из МО двух фрагментов СН3. Для этого составляются связывающие и антисвязывающие комбинации одинаковых орбиталией обоих фрагментов. На рис. 2.22 показана такая процедура для четырех нижних орбиталей фрагмента СН3, из которых получаются восемь нижних орбиталей этана (всего у этана четырнадцать молекулярных орбиталей). Поскольку этан имеет 14 валентных электронов, семь из построенных орбиталей будут заняты, а восьмая орбиталь (χ8) будет пустой, т.е. будет представлять собой НСМО. Из рисунка видно, что НСМО этана образуется путем антисвязывающей комбинации орбиталей ψ4 фрагментов СН3 и имеет характер разрыхляющей орбитали σ-связи С-С (σ*СС). ВЗМО молекулы этана представлены двумя вырожденными орбиталями ψ6 и ψ7, которые образуются путем антисвязывающих комбинаций (ψ2-ψ2) и (ψ3-ψ3).
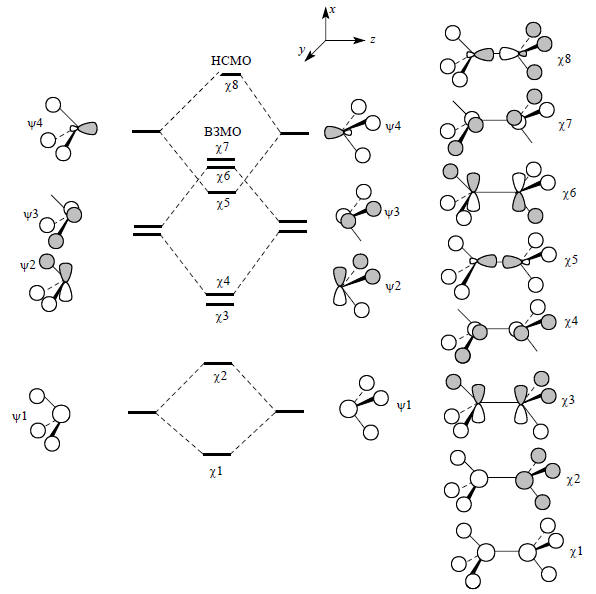 Рис. 2.22. Образование МО заторможенной конформации этана из двух пирамидальных фрагментов СН3
Рис. 2.22. Образование МО заторможенной конформации этана из двух пирамидальных фрагментов СН3
Пара вырожденных ВЗМО этана имеет характер разрыхляющих орбиталей С-С связей π-симметрии. Отметим, что расщепление несвязывающих орбиталей ψ4 больше, чем расщепление орбиталей ψ2 и ψ3. Это обусловлено большим перекрыванием орбиталей ψ4, которые гибридизованы навстречу друг другу. Поэтому высшая занятая МО образована не орбиталью χ5, а орбиталями χ6 и χ7. Нижние связывающие орбитали χ1 и χ2 имеют наибольшую плотность в районе связей С-Н. Связывание между атомами углерода осуществляется главным образом орбиталями χ3, χ4 и χ5, которые лежат выше, чем χ1 и χ2. Отсюда следует вывод, что в этане связи С-Н прочнее связей С-С. Это подтверждается термохимическими данными. Действительно, в этане энергия разрыва связи С-Н (98 ккал/моль) на 16 ккал/моль больше энергии связи С-С (82 ккал/моль).
Смотрите также
Дискриминация гипотез по кинетическим экспериментам
...
Расчет тарельчатой ректификационной колонны для разделения бинарной углеводородной смеси бензол-толуол
Ректификация
известна с начала девятнадцатого века, как один из важнейших технологических
процессов главным образом спиртовой и нефтяной промышленности. В настоящее время
ректификацию всё ш ...
Физико-химические методы анализа веществ
В практической
деятельности часто возникает необходимость идентификации (обнаружения) того или
иного вещества, а также количественной оценки (измерения) его содержания.
Химическая
иденти ...


