Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Многоатомные молекулыОткрытая химия / Химическая связь / Открытая химия / Химическая связь / Многоатомные молекулы Многоатомные молекулы
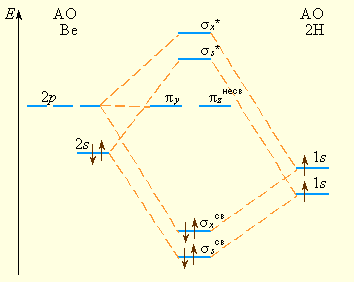
Рассмотрим некоторые многоатомные молекулы. Линейную молекулу BeH2 (существующую лишь в газовой фазе) образуют 1s-АО двух атомов водорода, одна 2s- и одна 2px-АО бериллия (рис 3.14). Им соответствуют две σ- и две σ*-МО. Но общее число участвующих в образовании МО BeH2 АО равно шести. Поэтому две из них не вносят вклад в стабилизацию молекулярной системы. Эти МО (πy, πz) называются несвязывающими.
 |
|
Рисунок 3.14 Энергетическая диаграмма МО молекулы BeH2 |
Электронная конфигурация ![]() –
– ![]()
Поскольку четыре валентных электрона располагаются на связывающих орбиталях, кратность трехцентровой связи равна двум. Обе электронные пары в молекуле
в равной степени принадлежат обоим атомам H, т. е. связи Be–H равноценны, поэтому каждой двухцентровой связи Be–H соответствует кратность 1.
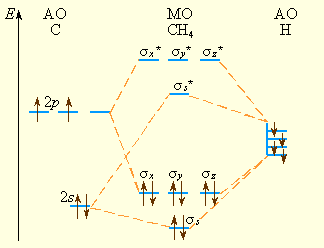
Аналогично составляются схемы МО и для других многоатомных молекул. В линейные комбинации включают только близкие по энергии и перекрывающиеся АО. Например, для тетраэдрической молекулы метана линейные комбинации из одной 2s-, трех 2px-, 2py-, 2pz-орбиталей углерода и четырех 1s-орбиталей водорода образуют σs, σs* и по три трехкратно вырожденных σsp связывающих и σsp* разрыхляющих MO, соответствующие четырем полностью равноценным пятицентровым связям. По характеру распределения электронной плотности все связи в молекуле CH4 равноценны. Существенно, что любой валентный электрон в молекуле CH4 может оказаться вблизи любого ее атома – связи в молекуле CH4 делокализованы (рис 3.15).
 |
|
Рисунок 3.15 Энергетическая диаграмма образования МО молекулы CH4 |
Смотрите также
Химический состав минеральных вод
Лечебными минеральными водами называются природные воды, которые
содержат в повышенных концентрациях те или другие минеральные (реже
органические) компоненты и газы и (или) обладают какими-н ...
Разработка методов и средств реабилитации объектов отравляющих веществ
Обеспечение безопасности людей и защита окружающей среды (ОС)
являются основополагающими требованиями Конвенции о запрещении разработки,
производства, накопления и применения химического ору ...
Марказит
Название происходит от
арабского "marcasitae", которым алхимики обозначали соединения серы,
в том числе и пирит. Другое название - "лучистый колчедан".
Спектропиритом назван за ...


