Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Теория образования оксидов азота при горении.Библиотека / Образование оксидов азота / Библиотека / Образование оксидов азота / Теория образования оксидов азота при горении. Теория образования оксидов азота при горении.Страница 1
Условия образования оксидов при горении до сих пор не разработаны в достаточной мере и требуют глубокой проработки весьма сложной химической кинетики процесса в сочетании с детальным изучением тепломассообмена и его влияния на кинетику. В 1960-70 гг. в большинстве публикаций в качестве основной модели образования NO принималась “термическая” схема. Согласно этой схеме выход NO определяется реакцией между атомом кислорода и молекулой азота. При этом количество атомарного кислорода определяется диссоциацией молекулы О2 . Эти процессы имеют очень большой энергетический барьер Е = 561 кДж/моль и, следовательно, определяются температурой процесса. Однако исследования за последние 20 лет показали:
· образование NO в пламенах имеет место не после окончания реакции горения, а не посредственно в зоне горения и зависит от ряда других химических реакций в пламенах. При этом собственно образование NO происходит не только в результате реакции атомарного кислорода с молекулой азота, но и в ряде других ;
· образование О в пламенях происходит не только за счёт диссоциации О2 , но и в ряде других реакций, концентрация атомарного кислорода в зоне горения на 1-2 порядка выше равновесного, определяемого из условий диссоциации молекулярного кислорода и в пламенах углеводородов составляет 0,4-0,8% ;
· максимальная температура в ядре зоны горения существенно ниже расчётной теоретической вследствие наличия сверхравновесных концентраций промежуточных продуктов реакций и теплообменных процессов ;
· зависимость выхода NO от температуры значительно слабее, чем это предполагалось ранее.
К настоящему времени приближенно до детальной разработки процесса можно отметить 3 основных группы источников образования оксида азота при горении, которые рассмотрим ниже.
“Термические” оксиды азота.
Условия протекания цепной реакции окисления атмосферного азота свободным кислородом при горении, формальная кинетика которой описывается уравнением :
![]() ,
,
В результате ряда работ различных учённых было получено уравнение для равновесного количества NO.
![]()
|
Температура, К |
300 |
700 |
800 |
1800 |
2500 |
|
Равновесная концентрация, [CNO], мг.м^3 |
0,00127 |
0,38 |
2,54 |
4700 |
31700 |
Так же была разработана цепная схема окисления азота, в которой активную роль играют свободные атомы кислорода и азота :
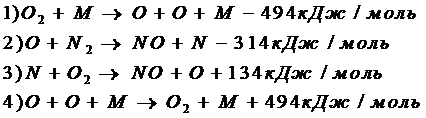
При этом концентрация атомарного кислорода остается неизменной, а скорость процесса определяется реакцией 2 схемы.
Энергетический барьер этой реакции складывается из двух составляющих :
а) энергии, требующейся на образование одного атома кислорода (Е1);
б) энергии активации реакции атома кислорода с молекулой азота (Е2);
Таким образом,
Е=Е1+Е2=494/2+314=516 кДж/моль.
Так как энергия активация этой реакции очень высока, то она предопределяет исключительно сильную зависимость скорости образования оксида азота от температуры.
Так же стоит отметить, что концентрация оксидов азота линейно увеличивается с увеличением концентрации атомарного кислорода и экспоненциально с увеличением температуры.
На основе имеющихся научных исследований были сформулированы методы подавления образования “термических” NO путем снижения скорости реакции их образования :
· снижение общего уровня температур в топке путем рециркуляции продуктов сгорания с Т<400 C, подачи пара и воды в зону горения и в дутьевой воздух ;
· снижение максимальных локальных температур в топке путём усиленной подачи газов рециркуляции, пара и воды в зоны максимальных температур (впрыск воды, пара в отдельные зоны факела, подача газов рециркуляции по оси, усиленная подача газов рециркуляции в центральные горелки) ;
· уменьшение максимальной температуры и содержания кислорода в зоне максимальных температур путем организации ступенчатого горения ;
Смотрите также
Пятая побочная подгруппа Периодической системы элементов Д.И. Менделеева
...
Классификация и взаимосвязь неорганических веществ
Классификация неорганических веществ
базируется на химическом составе – наиболее простой и постоянной во
времени характеристике. Химический состав вещества показывает, какие элементы
присутствуют в ...
Введение
Трудно переоценить значение крупномасштабного производства аренов для
химической промышленности и для всей экономики. Бензол и его производные
являются основным источником всех ароматических соедине ...


