Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Пространственное отталкивание и ван-дер-ваальсовы радиусыОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Пространственное отталкивание и ван-дер-ваальсовы радиусы Пространственное отталкивание и ван-дер-ваальсовы радиусыСтраница 1
На основании ранее изложенного создается впечатление, что молекулы стремятся только притягиваться друг к другу. Тем не менее, если они очень сближаются друг с другом, когда приходят в соприкосновение заполненные электронные оболочки атомов, входящих в состав молекулы, над силами притяжения начинают преобладать силы отталкивания. Например, два атома гелия на больших расстояниях слабо притягиваются друг к другу (поэтому существует жидкий гелий), но при тесном сближении, в силу того, что молекула Не2 образоваться не может (гл. 1, разд. 1.6), они отталкиваются, поскольку принцип Паули запрещает проникновение заполненных электронных оболочек друг в друга. Отталкивание резко возрастает с уменьшением расстояния; описать его очень сложно, так как оно зависит от конкретной электронной структуры частицы.В настоящее время наряду с эмпирическими подходами для изучения межмолекулярных взаимодействий все чаще используются методы квантовой химии. Расчеты потенциальных поверхностей (зависимости энергии взаимодействия от расстояния между молекулами и их взаимной ориентации) проведены для многих пар молекул. Эти расчеты позволили не только количественно описать межмолекулярные взаимодействия, но и разобраться в их физической природе. Оказалось, что во многих случаях межмолекулярное взаимодействие в значительной степени определяется переносом заряда с одной молекулы на другую, что не учитывали классические представления.Таблица 2.2 Ван-дер-ваальсовы (Rвдв) и ковалентные (Rков) радиусы (в Å)
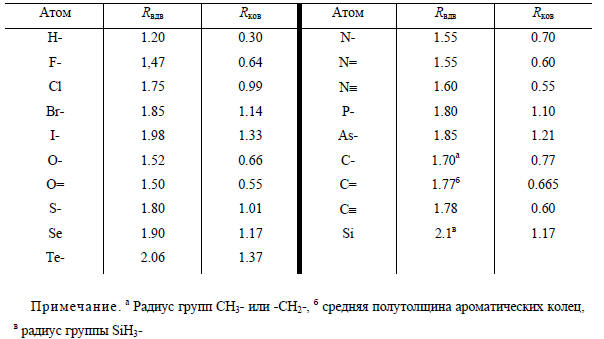
Таблица 2.3 Длина простых связей (Å)
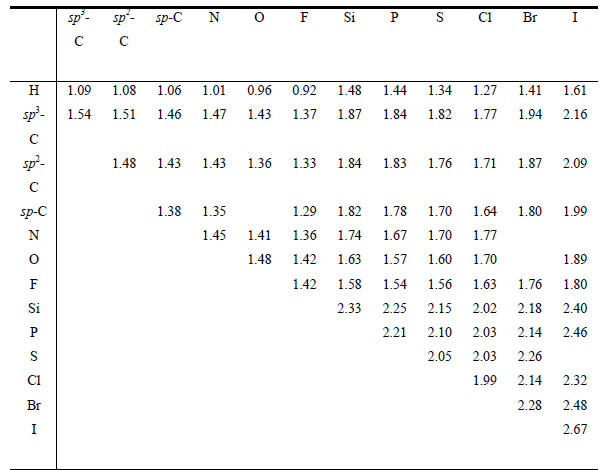
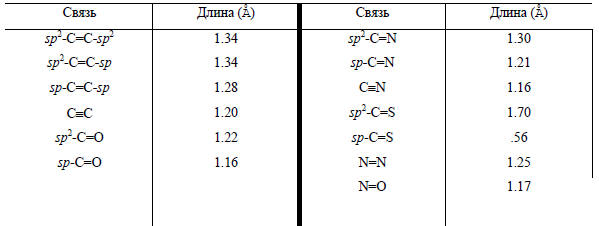
Примечание. Для каждой конкретной молекулы длины связей могут отличаться от приведенных из-за разницы в состоянии окисления, пространственного влияния заместителя, мезомерных эффектов и т.д.Расстояние, на котором силы притяжения и отталкивания равны, известно под названием ван-дер-ваальсового расстояния. Для данной пары атомов, соприкасающихся при контакте двух молекул, это расстояние зависит от природы других атомов, с которыми они связаны в молекуле, от относительной ориентации атомов по отношению к образуемым ими ковалентным связям и т.д. Тем не менее в известной степени эти ван-дер-ваальсовы расстояния можно выразить как сумму параметров, называемых ван-дер-ваальсовыми радиусами рассматриваемой пары атомов. Некоторые ван-дер- ваальсовы радиусы приведены в табл. 2.2. В этой же таблице приведены так называемые ковалентные радиусы, сумма которых определяет длину ковалентной связи между данной парой атомов. Ковалентные радиусы атомов, связанных простыми связями, обычно на 0.7-0.8 Å короче ван-дер-ваальсовых, однако они зависят от различия в электроотрицательности между связанными атомами, типа связи между атомами (простая, двойная, тройная) и т.д. В соответствии с этим меняются и длины ковалентных связей (табл. 2.3 и 2.4).Таблица 2.4 Длина кратных связей (см. примеч. к табл. 2.3)
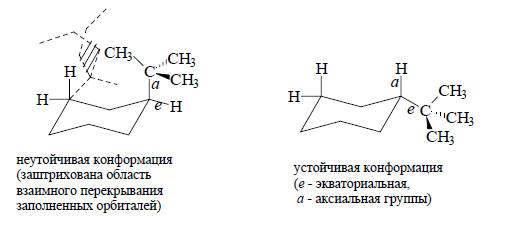
Величины ван-дер-ваальсовых радиусов определяют размеры и форму органических молекул, предпочтительную конформацию и наиболее стабильную конфигурацию. Например, в трет-бутилциклогексане, имеющем форму «кресла» (см. гл. 24), трет-бутильная группа всегда занимает экваториальное положение. Это связано с тем, что в аксиальной конформации из-за больших размеров (т.е. из-за большого ван-дер-ваальсова радиуса) трет-бутильной группы будет проявляться пространственное отталкивание между нею и аксиальными атомами водорода в положениях 3 и 5 (1,3-диаксиальное отталкивание, см. гл. 24):
Смотрите также
Введение
Трудно переоценить значение крупномасштабного производства аренов для
химической промышленности и для всей экономики. Бензол и его производные
являются основным источником всех ароматических соедине ...
Одноосновные насыщенные карбоновые кислоты
...
Химические свойства ароматических аминов
Ароматические амины имеют менее выраженный основный характер, чем
алифатические. Так, Кb метиламина составляет 4,4×10-5, тогда как для анилина Кb=3,8×10-10. Уменьшение основности анилина ...


