Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчётная частьБиблиотека / Нитрид бора и его физико-химические свойства / Библиотека / Нитрид бора и его физико-химические свойства / Расчётная часть Расчётная частьСтраница 1
Таблица данных взятых из справочника:
|
ΔH298, кДж/моль |
ΔS298, Дж/моль |
ΔG298, кДж/моль |
Ср Дж/моль | |
|
BN |
648 |
212 |
615 |
19.7 |
|
PH3 |
-5 |
210.2 |
- |
31 |
|
NH3 |
-46.2 |
192.6 |
- |
50.3 |
|
BP |
455 |
202.1 |
- |
- |
Рассчитаем тепловой эффект, энтропию, изменение стандартной энергии Гиббса при Т=2980 К и стандартном давлении для следующей реакции по формулам, используя таблицу данных.
BP+NH3 → BN(k)+PH3
ΔH298=∑nΔH298прод.-∑nΔH298исх.
ΔH298=(648+(-5))-(455+(-46,2))=234,2 · 103 Дж/моль
ΔS298=∑n ΔS298прод.- ∑n ΔS298исх.
ΔS298=(212+210,2)-(202,1+192,6)=27,6 Дж/моль
ΔG298= ΔH298-T · ΔS298
ΔG298=234,2 · 103-298·27,6=151 кДж/моль
Теперь рассчитаем всё тоже самое, но только в интервале температур 2980±150К и построим график зависимости ΔG=f(T).
ΔHT= ΔH298+∫298ΔCp dT
ΔST= ΔS298+∫298ΔCp/T dT
ΔGT= ΔHT- TΔST
Расчет:
ΔH283=648+19.7(283-298) = 352.5 кДж/моль
ΔH288=648+19.7(288-298) = 451 кДж/моль
ΔH293= 648+19.7(293-298) =623, 3 кДж/моль
ΔH298=648+19.7(298-298) =648 кДж/моль
ΔH303=648+19.7(303-298) =746, 5 кДж/моль
ΔH308=648+19.7(308-298) =845 кДж/моль
ΔH 313=648+19.7(313-298) =943.5 кДж/моль
ΔH318=648+19.7(318-298) =985 кДж/моль
ΔS283=27,6+19.7(ln283- ln 298)=26.61 кДж/моль
ΔS288=27,6+19.7(ln 288- ln 298)=27.01 кДж/моль
ΔS293=27,6+19.7(ln 293- ln 298)=27.4 кДж/моль
ΔS298=27,6+19.7(ln 298- ln 298)=27.6 кДж/моль
ΔS303=27,6+19.7(ln 303- ln 298)=28.7 кДж/моль
ΔS308=27,6+19.7(ln 308- ln 298)=28.9 кДж/моль
ΔS313=27,6+19.7(ln 313- ln 298)=29.3 кДж/моль
ΔS318=27,6+19.7 (ln 318- ln 298)=29.6 кДж/моль
ΔG283=352.5*103-283*26.61=345 кДж/моль
ΔG288=451-288*27.01=443.3 кДж/моль
ΔG293=623, 3-293*27.4=615.2 кДж/моль
ΔG298=648-298*27.6=639.7 кДж/моль
ΔG303=746, 5 -303*28.7=737.3кДж/моль
ΔG308=845-308*28.9=835.6кДж/моль
ΔG313=943.5 -313*29.3=933.3кДж/моль
ΔG318=985-318*29.6=975.4кДж/моль
T, K
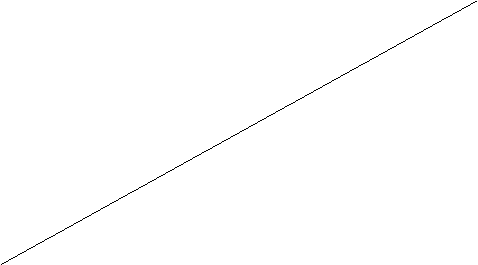
![]() 318
318
Смотрите также
Производство поливинилбутираля
Химическая
промышленность прошла бурный путь развития в период 50-х – 80-х годов. В
отрасли был создан значительный производственный потенциал. Однако он был
ориентирован на цели командно–а ...
Создание новых лекарственных веществ
Несмотря на достижения
современной анестезии, продолжаются поиски менее опасных средств для наркоза,
разработка различных вариантов многокомпонентного избирательного наркоза,
позволяющего з ...
Физико-химические методы определения фенола
Аналитическая химия – наука о методах определения химического состава
вещества и его структуры. Однако это определение КС представляется
исчерпывающим. Предметом аналитической химии являются ...


