Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Форма канонических молекулярных орбиталейОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Форма канонических молекулярных орбиталей Форма канонических молекулярных орбиталейСтраница 2
Таким образом, канонические орбитали правильно предсказывают существование двух потенциалов ионизации метана. Зато гибридизованные орбитали неправильно предсказывают всего один потенциал ионизации, но дают четкое представление о геометрии молекулы. Нельзя сказать, какие орбитали «лучше»; теоретики могут переводить канонические орбитали в гибридные и обратно.
Чтобы изобразить орбитали, представленные на рис. 1.14, необходимо затратить довольно много времени и иметь достаточные навыки в рисовании, что не всем доступно. Поэтому обычно используют приближенные эскизы, показывающие симметрию и узловые свойства орбиталей, правила построения которых будут даны в главе 2. Такие эскизы для молекулы СН4 приведены на рис. 1.15. Эскизные представления МО полезны тем, что на них ясно видно, из каких АО образуется данная МО. Так, орбитали ψ1 и ψ8 образуются путем перекрывания в фазе или противофазе С2s и четырех H1s, орбитали ψ2, ψ3, ψ4- путем перекрывания только H1s, а орбитали ψ5, ψ6 и ψ7 - путем перекрывания орбиталей С2р и H1s. Сравнение рис. 1.14 и 1.15 показывает, что эскизные орбитали сильно искажают реальную картину, но симметрию и узловые свойства передают правильно. Поскольку при рассмотрении реакционной способности органических молекул нас в первую очередь будут интересовать именно симметрия и узловые свойства, в последующих главах мы будем использовать главным образом эскизные орбитали.
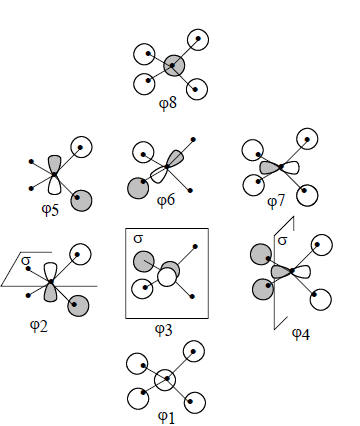
Рис. 1.15. Схематические изображения МО молекулы СН4, показывающие симметрию и узловые свойства орбиталей. Ср. с рис. 1.14.
Полярная молекула HF. На рис. 1.16 дана форма МО простейшей двухатомной гетероядерной молекулы HF. Поскольку валентная оболочка атома фтора описывается одной 2s- и тремя 2р-атомными орбиталями, а атом водорода имеет 1s -орбиталь, общее число образующихся молекулярных орбиталей в молекуле равно пяти. На четырех нижних по энергии орбиталях ψ1-ψ4 попарно размещаются восемь электронов, пятая орбиталь пустая. На рисунке, кроме объемных изображений МО, приведены также эскизы орбиталей, дающие представление о симметрии и о том, какие АО атома фтора использованы для образования данной МО.
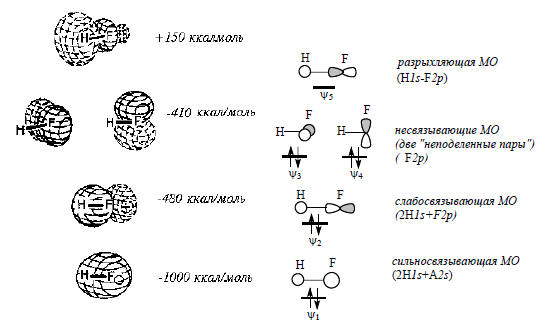
Рис. 1.16. МО молекулы HF
Две занятые орбитали с наибольшей энергией (ψ3 и ψ4) являются вырожденными; это орбитали π-типа, но электронной плотности у атома водорода в этих орбиталях совсем нет. Они называются несвязывающими орбиталями, так как не связывают атомы Н и F, и занимающие их электроны в классической теории называются «неподеленными парами электронов». Важная особенность молекулы НF состоит в том, что плотность валентных электронов распределена по молекуле неравномерно, она гораздо выше вокруг атома фтора. Об этом говорит, например, вид самой низкой связывающей МО ψ1 (рис. 1.16), по форме напоминающей яйцо, в остром конце которого распоолагается ядро атома водорода, а в тупом - ядро атома фтора. Во всех связывающих и несвязывающих орбиталях HF объем орбиталей у атома фтора больше, чем у атома водорода, что эквивалентно большей электронной плотности у атома фтора. Таким образом, полярность молекулы, выражаемая формулой Hδ+-Fδ-, отражается и в форме канонических молекулярных орбиталей.
Смотрите также
Окись этилена
Окись
этилена является одним из наиболее крупнотоннажных продуктов органического
синтеза, получаемых на основе этилена. Производные окиси этилена (гликоли и их
эфиры, этаноламины, поверхнос ...
Общие сведения о спиртах. Полиолы
...
Свойства d-элементов 4-го периода.
Цель
работы - изучение химических свойств некоторых переходных металлов и их
соединений.
Металлы
побочных подгрупп, так называемые переходные элементы относятся к d - элементам,
поскольку в их ...


