Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
МолибденБиблиотека / Библиотека / Молибден МолибденСтраница 8
Важной характеристикой любого гальванического элемента будет его ЭРС. Она равна: ![]() , если округлить полученное значение ЭРС, то мы получим:
, если округлить полученное значение ЭРС, то мы получим: ![]() . При вычислении ЭРС мы не учитывали влияния концентрации ионов на величину потенциала, а приведенные значения точны только для ситуации, когда концентрации веществ равны нулю. Поэтому значение ЭРС в реальных гальванических элементах будет несколько другим. Также надо отметить, что чаще используется медно-цинковые гальванические элементы, которые более дешевы чем элементы с использованием молибдена
. При вычислении ЭРС мы не учитывали влияния концентрации ионов на величину потенциала, а приведенные значения точны только для ситуации, когда концентрации веществ равны нулю. Поэтому значение ЭРС в реальных гальванических элементах будет несколько другим. Также надо отметить, что чаще используется медно-цинковые гальванические элементы, которые более дешевы чем элементы с использованием молибдена
10.4. Опишите процесс электрохимической коррозии при контакте металла и изделия из Mg во влажной среде (Без аэрации и при аэрации). PH=10
Очевидно, что образуется гальванический элемент. В полученном гальваническом элементе один из металлов, а именно более активный, будет окислятся, а на менее активном будет восстанавливаться ион ОН-, или какой то другой ион.
Имеем короткозамкнутый элемент, где магний является анодом, а молибден – катодом. Как видно из условия РН раствора щелочной, РН=10.
В разбавленных щелочах цинк реагирует по уравнению:
![]() , поскольку в растворе есть большое количество ионов ОН- то это будет несколько тормозить реакцию окисления магния, равновесие реакции сдвинется влево.
, поскольку в растворе есть большое количество ионов ОН- то это будет несколько тормозить реакцию окисления магния, равновесие реакции сдвинется влево.
Поскольку молибден находится в контакте с магнием и оба эти металла окружены раствором электролита, гальванический элемент оказывается «включенным». Магний в виде иона Mg2+ переходит в раствор щелочи, а оставшиеся от каждого атома два электрона перетекают на более электроположительный металл – молибден :
Mg = Mg2+ + 2e–
К молибденовому катоду подходят ионы водорода, принимают электроны и превращаются в атомы водорода, а затем и в молекулы водорода:
Н+ + е- = Н; 2Н = H2
Таким образом, потоки движения ионов разделены и при избытке щелочи процесс протекает до тех пор, пока не растворится весь магний. Мы рассмотрели процесс электрохимической коррозии при отсутствии поступления воздуха.
В присутствии воздуха в растворе протекают следующие реакции:
Mg + H2O + 1/2O2 = Mg(OH)2
![]()
При наличии в растворе газообразного кислорода и невозможности протекания процесса коррозии с водородной деполяризацией основную роль деполяризатора исполняет кислород. Коррозионные процессы, у которых катодная деполяризация осуществляется растворенным в электролите кислородом, называют процессами коррозии металлов с кислородной деполяризацией. Это наиболее распространенный тип коррозии металла в воде.
Общая схема кислородной деполяризации сводится к восстановлению молекулярного кислорода до иона гидроокисла:
O2 +2H2O + 4e- = 4OH-
Суммарно на аноде будет проходить растворение магния, на катоде – выделение гидроксид-ионов. Процесс будет протекать до полного растворения магния и перехода его в гидроксид.
10.5. Опишите процесс электролиза с учетом перенапряжения.Электролит – раствор ![]() PH= 4, 5
PH= 4, 5
Электроды: катод – Сu,
анод – Zn.
В растворе хлорид молибдена будет диссоциировать на ионы согласно уравнения:
![]()
Рассмотрим процессы, которые будут происходить на аноде.
Анод цинковый. На цинковом аноде могут происходить несколько процесов:
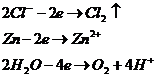
Запишем потенциалы прохождения указанных процессов:
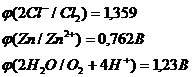
Перенапряжение выделения кислорода на цинковом электроде при плотности тока 1мА/см2 равно 1,75 В. Это значит, что кислород в данной реакции выделятся не будет и на аноде возможны только две электрохимические реакции:
![]()
Как видно из значений электродных потенциалов на аноде будет происходить реакция окисления цинка: ![]() , потенциал которой будет ниже чем потенциал восстановления хлора. Мы будем иметь дело с электрорафинированием цинка.
, потенциал которой будет ниже чем потенциал восстановления хлора. Мы будем иметь дело с электрорафинированием цинка.
Рассмотрим электродные процессы на катоде. Материал катода – медь, катод довольно инертен и не будет брать участия в электрохимических процессах. Конечно мы только допускаем это, медь содержит некоторые примеси, которые и будут брать участие в электродных реакциях, но мы считаем, что эти процессы не повлияют существенно на суммарную реакцию. На катоде также возможны несколько реакций, рассмотрим их.
Смотрите также
Насыщенные альдегиды и кетоны
Альдегиды
и кетоны относятся к карбонильным соединениям (содержат группу >С=О) Они
имеют общую формулу:
для
альдегидов R1=H.
Изомерия
кетонов связана со строением радикалов и с п ...
Обозначения.
Vп
Мольный
объем паровой фазы
Vж
Мольный
объем жидкой фазы
Sп
Мольная
энтропия паровой фазы
Sж
...
Жидкофазный металлокомплексный катализ
Все реакционные системы
принято делить на гомофазные и гетерофазные. В первом случае в реакционной
системе отсутствуют границы раздела фаз. Катализатор и реагенты находятся в
одной фазе и в ...


