Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Окислители и восстановителиCправочник по химии для подготовки к ЕГЭ / Окислительно‑восстановительные реакции. Электролиз / Cправочник по химии для подготовки к ЕГЭ / Окислительно‑восстановительные реакции. Электролиз / Окислители и восстановители Окислители и восстановители
Окислительно‑восстановительные реакции протекают с одновременным повышением и понижением степеней окисления элементов и сопровождаются передачей электронов:
![]()
Повышение
степени окисления элемента в ходе реакции, отвечающее потере
электронов атомами этого элемента, называют окислением: S‑II – 6е‑ = SIV. В данном примере S‑II окисляется до SIV.
Понижение
степени окисления элемента в ходе реакции, отвечающее присоединению электронов атомами этого элемента, называется восстановлением: O0 + 2е‑ = О‑II. В данном примере О0 восстанавливается до O‑II.
Вещество, частицы которого содержат окисляющиеся атомы, выполняет в реакции функцию
восстановителя. В данном примере восстановитель – сероводород H2S.
Вещество, частицы которого содержат восстанавливающиеся атомы, выполняет в реакции функцию
окислителя. В данном примере окислитель – молекулярный кислород O2.
Вещества, являющиеся окислителями или восстановителями во многих реакциях, называются типичными (сильными).
Многие вещества могут проявлять как окислительные, так и восстановительные свойства. К таким веществам принадлежат соединения, содержащие элементы в промежуточной (для них) степени окисления:
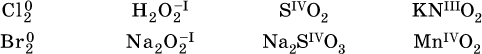
Окислительно‑восстановительные свойства веществ связаны с положением элементов в Периодической системе Д. И. Менделеева. Простые вещества – неметаллы обладают бóльшими окислительнымисвойствами, а металлы – бóльшими восстановительными
свойствами (O2, Cl2 – окислители; Na, Ва, Al и Zn – восстановители).
В каждой группе Периодической системы элемент с большим
порядковым номером будет обладать и бóльшими восстановительными
свойствами в своей группе, а элемент с меньшимпорядковым номером – бóльшими окислительными
свойствами. Так, кальций Са – более сильный восстановитель, чем магний Mg, молекулярный хлор Cl2 – более сильный окислитель, чем иод I2.
Соединения, содержащие атомы элементов в низкой степени окисления, будут восстановителями за счет этих атомов, например: NH3 – восстановитель за счет азота (‑III), H2S – за счет серы (‑II), KI – за счет иода (‑I) и т. д.
Соединения, включающие атомы элементов в высокойстепени окисления, будут окислителями
, например: HNO3 – окислитель за счет азота (+V), КMnO4 – за счет марганца (+VII), К2Cr2O7 – за счет хрома (+VI) и т. д.
Смотрите также
Приложение.
I.
Некоторые
физические константы:
константа
обозначение
...
Риформинг как способ получения бензинов с улучшенными характеристиками
Бензины являются
одним из основных видов горючего для двигателей современной техники.
Автомобильные и мотоциклетные, лодочные и авиационные поршневые двигатели
потребляют бензины. В настоящ ...
Понятие и биологическая роль ферментов
Я выбрала тему «Ферменты.
Биокатализ. Возможности биомиметики», потому что в последнее время в качестве
лекарственных средств стали широко применять препараты, оказывающие
направленное влия ...


