Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Серная кислота. СульфатыCправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Серная кислота. Сульфаты Серная кислота. СульфатыСтраница 1
Серная кислота
H2SO4.
Оксокислота. Бесцветная жидкость, очень вязкая (маслообразная), весьма гигроскопичная. Молекула имеет искаженно‑тетраэдрическое строение [S(O)2(OH)2] (sр3‑гибридизация), содержит ковалентные σ‑связи S – ОН и σπ‑связи S=O. Ион SO42‑ имеет правильно‑тетраэдрическое строение [S(O)4]. Обладает широким температурным интервалом жидкого состояния (~300 градусов). При нагревании выше 296 °C частично разлагается. Перегоняется в виде азеотропной смеси с водой (массовая доля кислоты 98,3 %, температура кипения 296–340 °C), при более сильном нагревании разлагается полностью. Неограниченно смешивается с водой (с сильным экзо‑эффектом). Сильная кислота в растворе, нейтрализуется щелочами и гидратом аммиака. Переводит металлы в сульфаты (при избытке концентрированной кислоты в обычных условиях образуются растворимые гидросульфаты), но металлы Be, Bi, Со, Fe, Mg и Nb пассивируются в концентрированной кислоте и не реагируют с ней. Реагирует с основными оксидами и гидроксидами, разлагает соли слабых кислот. Слабый окислитель в разбавленном растворе (за счет НI), сильный – в концентрированном растворе (за счет SVI). Хорошо растворяет SO3 и реагирует с ним (образуется тяжелая маслообразная жидкость – олеум, содержит H2S2O7).
Качественная реакция на ион SO42‑ – осаждение белого сульфата бария BaSO4 (осадок не переводится в раствор соляной и азотной кислотами, в отличие от белого осадка BaSO3).
Применяется в производстве сульфатов и других соединений серы, минеральных удобрений, взрывчатых веществ, красителей и лекарственных препаратов, в органическом синтезе, для «вскрытия» (первого этапа переработки) промышленно важных руд и минералов, при очистке нефтепродуктов, электролизе воды, как электролит свинцовых аккумуляторов. Ядовита, вызывает ожоги кожи. Уравнения важнейших реакций:
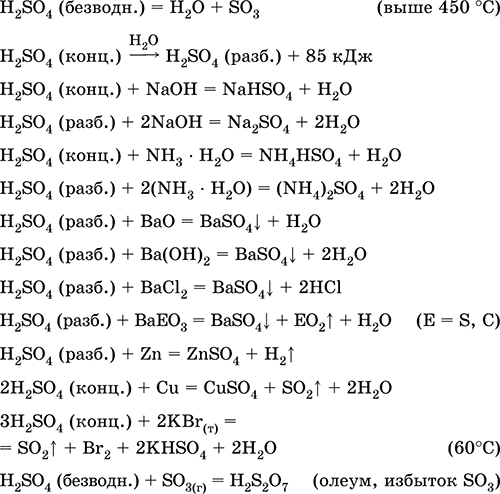
Получение в промышленности
:
а) синтез SO2 из серы, сульфидных руд, сероводорода и сульфатных руд:
S + O2 (воздух) = SO2
(280–360 °C)
4FeS2 + 11O2 (воздух) = 8SO2
+ 2Fe2O3 (800 °C, обжиг)
2H2S + 3O2 (изб.) = 2SO2
+ 2Н2O (250–300 °C)
CaSO4 + С (кокс) = СаО + SO2
+ СО (1300–1500 °C)
б) конверсия SO2 в SO3 в контактном аппарате:
![]()
в) синтез концентрированной и безводной серной кислоты:
Н2O (разб. H2SO4) + SO3 = H2SO4
(конц., безводн.)
(поглощение SO3 чистой водой с получением H2SO4 не проводится из‑за сильного разогревания смеси и обратного разложения H2SO4, см. выше);
г) синтез олеума – смеси безводной H2SO4, дисерной кислоты H2S2O7 и избыточного SO3. Растворенный SO3 гарантирует безводность олеума (при попадании воды тут же образуется H2SO4), что позволяет безопасно перевозить его в стальных цистернах.
Сульфат натрия Na2SO4.
Оксосоль. Белый, гигроскопичный. Плавится и кипит без разложения. Образует кристаллогидрат (минерал мирабилит), легко теряющий воду; техническое название глауберова соль. Хорошо растворим в воде, не гидролизуется. Реагирует с H2SO4 (конц.), SO3. Восстанавливается водородом, коксом при нагревании. Вступает в реакции ионного обмена.
Применяется в производстве стекла, целлюлозы и минеральных красок, как лекарственное средство. Содержится в рапе соляных озер, в частности в заливе Кара‑Богаз‑Гол Каспийского моря.
Уравнения важнейших реакций:
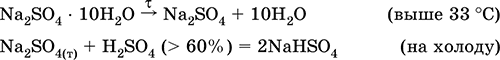
Смотрите также
Исследование растворимости и ионного обмена как инструмент изучения равновесий в водном растворе
...
Методы определения активности катализаторов
...
Вулканизация каучуков
Фторкаучуки вулканизуются
при нагревании смесей, содержащих вулканизующие агенты, или под действием
излучений высокой энергии. Степень радиационной вулканизации фторкаучуков тем
выше, чем больше со ...


