Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Сера. Сероводород. СульфидыCправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Сера. Сероводород. Сульфиды Сера. Сероводород. СульфидыСтраница 2
Качественные реакции на ион S2‑ – осаждение разноокрашенных сульфидов металлов, из которых MnS, FeS, ZnS разлагаются в НCl (разб.).
Применяется в производстве сернистых красителей и целлюлозы, для удаления волосяного покрова шкур при дублении кож, как реагент в аналитической химии.
Уравнения важнейших реакций:
Na2S + 2НCl (разб.) = 2NaCl + H2S↑
Na2S + 3H2SO4 (конц.) = SO2↑ + S↓ + 2H2O + 2NaHSO4 (до 50 °C)
Na2S + 4HNO3 (конц.) = 2NO↑ + S↓ + 2H2O + 2NaNO3 (60 °C)
Na2S + H2S (насыщ.) = 2NaHS
Na2S(т) + 2O2 = Na2SO4 (выше 400 °C)
Na2S + 4H2O2 (конц.) = Na2SO4 + 4H2O
S2‑ + M2+ = MnS (телесн.)↓; FeS (черн.)↓; ZnS (бел.)↓
S2‑ + 2Ag+ = Ag2S (черн.)↓
S2‑ + M2+ = СdS (желт.)↓; PbS, CuS, HgS (черные)↓
3S2‑ + 2Bi3+ = Bi2S3 (кор. – черн.)↓
3S2‑ + 6H2O + 2M3+ = 3H2S↑ + 2M(OH)3↓ (M = Al, Cr)
Получение в промышленности– прокаливание минерала мирабилит Na2SO4 10Н2O в присутствии восстановителей:
Na2SO4 + 4Н2 = Na2S + 4Н2O (500 °C, кат. Fe2O3)
Na2SO4 + 4С (кокс) = Na2S + 4СО (800–1000 °C)
Na2SO4 + 4СО = Na2S + 4СO2 (600–700 °C)
Сульфид алюминия Al2S3.
Бескислородная соль. Белый, связь Al – S преимущественно ковалентная. Плавится без разложения под избыточным давлением N2, легко возгоняется. Окисляется на воздухе при прокаливании. Полностью гидролизуется водой, не осаждается из раствора. Разлагается сильными кислотами. Применяется как твердый источник чистого сероводорода. Уравнения важнейших реакций:
Al2S3 + 6Н2O = 2Al(ОН)3↓ + 3H2S↑ (чистый)
Al2S3 + 6НCl (разб.) = 2AlCl3 + 3H2S↑
Al2S3 + 24HNO3 (конц.) = Al2(SO4)3 + 24NO2↑ + 12H2O (100 °C)
2Al2S3 + 9O2 (воздух) = 2Al2O3 + 6SO2 (700–800 °C)
Получение: взаимодействие алюминия с расплавленной серой в отсутствие кислорода и влаги:
2Al + 3S = AL2S3
(150–200 °C)
Сульфид железа (II) FeS.
Бескислородная соль. Черно‑серый с зеленым оттенком, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа(II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода.
Соединение железа(III) состава Fe2S3 не известно (не получено).
Уравнения важнейших реакций:
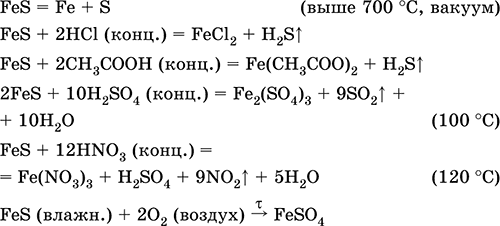
Получение:
Fe + S = FeS
(600 °C)
Fe2O3 + H2 + 2H2S = 9FeS
+ 3H2O (700‑1000 °C)
FeCl2 + 2NH4HS (изб.) = FeS↓ + 2NH4Cl + H2S↑
Дисульфид железа FeS2.
Бинарное соединение. Имеет ионное строение Fe2+ (–S – S–)2‑. Темно‑желтый, термически устойчивый, при прокаливании разлагается. Нерастворим в воде, не реагирует с разбавленными кислотами, щелочами. Разлагается кислотами‑окислителями, подвергается обжигу на воздухе. Применяется как сырье в производстве чугуна, серы и серной кислоты, катализатор в органическом синтезе. В природе – рудные минералы пирит и марказит.
Уравнения важнейших реакций:
FeS2 = FeS + S (выше 1170 °C, вакуум)
2FeS2 + 14H2SO4 (конц., гор.) = Fe2(SO4)3 + 15SO2↑ + 14Н2O
FeS2 + 18HNO3 (конц.) = Fe(NO3)3 + 2H2SO4 + 15NO2↑ + 7H2O
4FeS2 + 11O2 (воздух) = 8SO2 + 2Fe2O3 (800 °C, обжиг)
Гидросульфид
аммония
NH4HS.
Бескислородная кислая соль. Белый, плавится под избыточным давлением. Весьма летучий, термически неустойчивый. На воздухе окисляется. Хорошо растворим в воде, гидролизуется по катиону и аниону (преобладает), создает щелочную среду. Раствор желтеет на воздухе. Разлагается кислотами, в насыщенном растворе присоединяет серу. Щелочами не нейтрализуется, средняя соль (NH4)2S не существует в растворе (условия получения средней соли см. в рубрике «H2S»). Применяется в качестве компонента фотопроявителей, как аналитический реагент (осадитель сульфидов).
Уравнения важнейших реакций:
NH4HS = NH3 + H2S (выше 20 °C)
NH4HS + НCl (разб.) = NH4Cl + H2S↑
NH4HS + 3HNO3 (конц.) = S↓ + 2NO2↑ + NH4NO3 + 2H2O
2NH4HS (насыщ. H2S) + 2CuSO4 = (NH4)2SO4 + H2SO4 + 2CuS↓
Получение: насыщение концентрированного раствора NH3 сероводородом:
NH3 Н2O (конц.) + H2S(г) = NH4HS
+ Н2O
В аналитической химии раствор, содержащий равные количества NH4HS и NH3 Н2O, условно считают раствором (NH4)2S и используют формулу средней соли в записи уравнений реакций, хотя сульфид аммония полностью гидролизуется в воде до NH4HS и NH3 • Н2O.
Смотрите также
Гидроксикарбонильные соединения. Дикарбоновые кислоты
a-Гидроксикарбонильные
соединения, как уже отмечалось, могут быть получены окислением диолов
гипобромитом натрия или реагентом Фентона.
Для
a-гидроксикарбонильных
соединений характерна ...
Гидроочистка дизельных топлив
...
Расчет концентрации бензола в поглотительном масле. Определение расхода греющего пара
Абсорбер для
улавливания паров бензола из парогазовой смеси орошается поглотительным маслом
с мольной массой 260 кг/кмоль. среднее давление в абсорбере Рабс.=800
мм.рт.ст., температура 40°С ...


