Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Халькогены. КислородCправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Халькогены. Кислород Халькогены. КислородСтраница 2
Применяется для дезинфекции питьевой воды, при отбеливании тканей и минеральных масел, как реагент в
неорганическом и органическом синтезе. В атмосфере Земли озоновый слой (на высоте =25 км) защищает живой мир от воздействия космического ультрафиолетового излучения.
Атомарный кислород О0.
Третья аллотропная форма кислорода. Более сильный окислитель по сравнению с O2 и O3. Образуется при распаде молекул O2 и O3 под действием ультрафиолетового излучения. Возникает при термическом разложении кислородсодержащих веществ (см. выше, получение O2); при отсутствии восстановителей тут же переходит снова в O2 и O3, в присутствии восстановителей окисляет их:
KNO3 = KNO2 + O0
О0
+ С (графит) = СO2
Поэтому вещества, легко отщепляющие кислород при нагревании, проявляют сильные окислительные свойства.
Пероксид водорода Н2O2.
Бинарное соединение. Молекула Н2O2 неплоская, имеет строение с σ‑связью О – О на ребре и связями Н – О на плоскостях двугранного угла. Степень окисления кислорода равна – I. Группа – О – О– называется пероксогруппой.
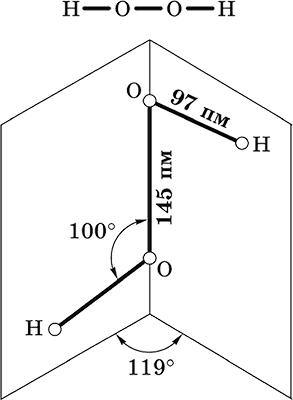
Бесцветная жидкость, вязкая, тяжелее воды, чувствительна к свету и примесям (стабилизатор Н3РO4). Разлагается со взрывом при слабом нагревании, на катализаторе – при комнатной температуре. Неограниченно смешивается с водой. Разбавленными щелочами нейтрализуется не полностью. Сильный окислитель, слабый восстановитель.
Пероксид водорода применяется как отбеливатель текстиля, бумаги, кож, жиров и минеральных масел, окислитель ракетного топлива, реагент в органическом синтезе, при осветлении картин старых мастеров (потемневший красочный слой из‑за перехода белил – гидроксокарбонатов свинца – в черный PbS осветляют переводом в белый PbSO4). В промышленности обычно используют взрывобезопасный 30 %‑ный раствор Н2O2 (пергидроль), в медицине – 3 %‑ный раствор.
Уравнения важнейших реакций:
2Н2O2 = 2Н2O + O2 (выше 150 °C или на кат. MnO2)
Н2O2 (разб.) + NaOH (разб.) = NaHO2 + Н2O
Н2O2 (конц.) + 2NaOH(т) = Na2O2↓ + 2H2O (0 °C)
Н2O2 (3 %) + 2H+ + 2I‑ = I2↓ + 2Н2O
5Н2O2 (30 %) + I2(т) = 2НIO3 + 4Н2O
Н2O2 (10 %) + SO32‑ = SO32‑ + H2O
4Н2O2 (30 %) + PbS (черн.) = 4H2O + PbSO4 (бел.)↓
3H2O2 + 2[Cr(OH)6]3‑ = 2CrO42‑ + 8H2O + 2OH‑
2Н2O2 (конц.) + Са(ClO)2 = СаCl2 + 2Н2O + 2O2↑
5H2O2 + 6H+ + 2MnO4‑ = 2Mn2+ + 5O2↑ + 8Н2O
Получение: в лабораториивначале синтезируют пероксид бария ВаO2:
2ВаО + O2 (изб.) = 2ВаO2 (до 500 °C),
а затем его обрабатывают серной кислотой:
ВаO2 + H2SO4 = BaSO4↓ + Н2O2
(на холоду)
В промышленности
(старый метод) – электролиз водного раствора H2SO4 или (NH4)2SO4 в специальных условиях; при этом кислота или соль не расходуются, а протекает электролиз воды с образованием на аноде Н2O2:
![]()
Современный промышленный способ (8O% мирового производства) – окисление сложного органического соединения 2‑этилантрагидрохинон кислородом воздуха на холоду.
Смотрите также
Приготовление основных стандартных растворов металлов с
концентрацией
1.
Средства измерений, реактивы, оборудование
Весы
лабораторные аналитические любого типа 2-го класса точности
Колбы
мерные наливные : 2-1000-2 по ГОСТ 1770
Цилиндры
мерные: 1-50 по ГОСТ ...
Определение содержания аскорбиновой кислоты в яблоках различных сортов
Большинство зимних сортов яблок отличается невысокой
С-Р витаминностью, и на них можно не останавливаться. Количество витамина С к
весне обычно составляет у яблок половину бывшего к потреби ...


