Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Изобарно-изотермический потенциалСтатьи и работы по химии / Статьи и работы по химии / Изобарно-изотермический потенциал Изобарно-изотермический потенциалСтраница 1
9. Определить изменение изобарно-изотермического потенциала реакции N2(г) + 2Н2О(ж) = NH4NO2 (ж) и дать заключение о направлении ее протекания при стандартных условиях, если
![]() для Н2О(ж) равна – 237,4 кДж/моль, а для NH4NO2(ж) равна – 115,8 кДж/моль.
для Н2О(ж) равна – 237,4 кДж/моль, а для NH4NO2(ж) равна – 115,8 кДж/моль.
Решение.
Изобарно-изотермический потенциал реакции рассчитывается так же, как и тепловой эффект реакции – по стандартным теплотам образования веществ:
![]()
![]()
![]() Следовательно, реакция может идти в обратном направлении.
Следовательно, реакция может идти в обратном направлении.
17. При температуре 298 К реакция заканчивается через 2,5 ч. Рассчитать, при какой температуре она закончится через 20 мин., если температурный коэффициент реакции равен 3.
Решение.
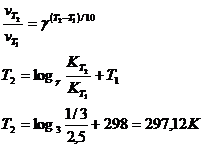
Ответ: 297 К.
25. Уравнение изотермы химической реакции Вант-Гоффа.
В соответствии с законом действующих масс для произвольной реакции
а A + b B = c C + d D
уравнение скорости прямой реакции можно записать:
![]() ,
,
а для скорости обратной реакции: ![]() .
.
По мере протекания реакции слева направо концентрации веществ А и В будут уменьшаться и скорость прямой реакции будет падать. С другой стороны, по мере накопления продуктов реакции C и D скорость реакции справа налево будет расти. Наступает момент, когда скорости υ 1 и υ 2 становятся одинаковыми, концентрации всех веществ остаются неизменными, следовательно,
![]() ,
,
Откуда Kc = k1 / k2 = ![]() .
.
Постоянная величина Кс, равная отношению констант скоростей прямой и обратной реакций, количественно описывает состояние равновесия через равновесные концентрации исходных веществ и продуктов их взаимодействия (в степени их стехиометрических коэффициентов) и называется константой равновесия. Константа равновесия является постоянной только для данной температуры, т.е.
Кс = f (Т). Константу равновесия химической реакции принято выражать отношением, в числителе которого стоит произведение равновесных молярных концентраций продуктов реакции, а в знаменателе – произведение концентраций исходных веществ.
Если компоненты реакции представляют собой смесь идеальных газов, то константа равновесия (Кр) выражается через парциальные давления компонентов:
Kp = ![]() .
.
Для перехода от Кр к Кс воспользуемся уравнением состояния P · V = n·R·T. Поскольку
![]() , то P = C·R·T.
, то P = C·R·T.
Тогда ![]() .
.
Из уравнения следует, что Кр = Кс при условии, если реакция идет без изменения числа моль в газовой фазе, т.е. когда (с + d) = (a + b).
Если реакция (1.33) протекает самопроизвольно при постоянных Р и Т или V и Т, то значения D G и D F этой реакции можно получить из уравнений:
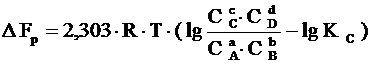 ,
,
где С А, С В, С С, С D – неравновесные концентрации исходных веществ и продуктов реакции.
Смотрите также
Производство уксусной кислоты
Уксусная кислота — первая из органических кислот, которая стала известна
человеку. Впервые она была получена И.Глаубером в 1648 г. и в концентрированном виде путем вымораживания ее водных рас ...


