Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Производство сталиCправочник по химии для подготовки к ЕГЭ / Переходные металлы 4‑го периода. Свойства, способы получения.
Общие свойства металлов / Cправочник по химии для подготовки к ЕГЭ / Переходные металлы 4‑го периода. Свойства, способы получения.
Общие свойства металлов / Производство стали Производство сталиСтраница 1
Передел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700–2000 °C. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СO2, SO2), либо связываются в легко отделяемый шлак – смесь Са3(РO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Получение чистого железа в промышленности – электролиз раствора солей железа, например:
![]()
(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун – в производстве литья и стали, сталь – как конструкционный и инструментальный материалы, в том числе износо‑, жаро– и коррозионно‑стойкие.
Оксид железа(II) FeO.
Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Fe2+O2‑. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
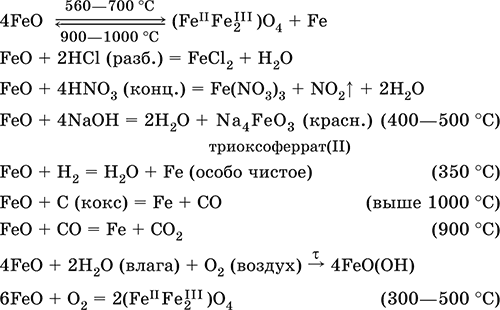
Получение в лаборатории
: термическое разложение соединений железа (II) без доступа воздуха:
Fe(OH)2 = FeO
+ H2O (150–200 °C)
FeCO3 = FeO
+ СO2 (490–550 °C)
Оксид
дижелеза
(III) – железа
(II)
(FeIIFe2III)O4.
Двойной оксид. Черный, имеет ионное строение Fe2+(Fe3+)2(O2‑)4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто‑формулы Fe3O4 не рекомендуется. Уравнения важнейших реакций:
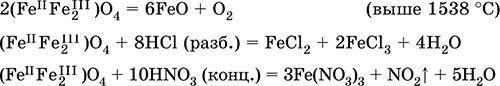
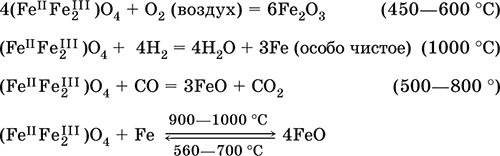
Получение: сгорание железа (см.) на воздухе.
В природе – оксидная руда железа магнетит.
Оксид железа(III) Fe2O3.
Амфотерный оксид с преобладанием основных свойств. Красно‑коричневый, имеет ионное строение (Fe3+)2(O2‑)3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fe2O3 nН2O. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды – шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Смотрите также
Расчеты и прогнозирование свойств органических соединений
Задание 24А
на курсовую работу по дисциплине "Расчеты
и прогнозирование свойств органических соединений"
1) Для четырех соединений, приведенных в
таблице, вычислить , , мето ...
Нестероидные противовоспалительные препараты. Салицилаты
...
Атомно-молекулярное учение и его законы
Химия - наука о веществах, изучающая их состав, строение,
свойства, а также превращения веществ, на сопровождающиеся изменением состава
атомных ядер.
Использование для нужд человека природных рес ...


