Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
МарганецCправочник по химии для подготовки к ЕГЭ / Переходные металлы 4‑го периода. Свойства, способы получения.
Общие свойства металлов / Cправочник по химии для подготовки к ЕГЭ / Переходные металлы 4‑го периода. Свойства, способы получения.
Общие свойства металлов / Марганец МарганецСтраница 1
Марганец – элемент 4‑го периода и VIIB‑группы Периодической системы, порядковый номер 25. Электронная формула атома [18Ar]3d54s2; характерные степени окисления +VII, +VI, +IV, +II и 0.
Шкала степеней окисления марганца:
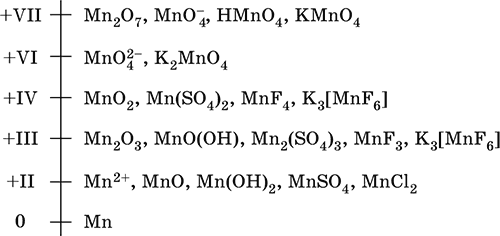
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Mg) и неметаллами (F, О, N, Cl). Соединения MnII – оксид и гидроксид – проявляют основные свойства, соединения MnIII и MnIV – амфотерные свойства, для соединений MnVI и MnVII характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
В природе – четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец Mn.
Серебристо‑белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
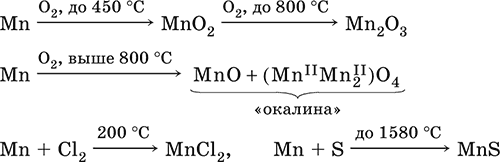
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород:
Mn (порошок) + 2H+ = Mn2+ + Н2↑
Взаимодействует с кислотами‑окислителями при нагревании, также образуя соли марганца (II):
Mn + 2H2SO4 (конц.) = MnSO4 + SO2↑ + 2Н2O
ЗMn + 8HNO3 (разб.) = 3Mn(NO3)2 + 2NO↑ + 4Н2O
Получение марганца в промышленности
– восстановление пиролюзита MnO2 или гаусманита (MnIIMn2III)O4 коксом или алюминием:
MnO2 + С (кокс) = Mn
+ СO2 (600 °C)
3(MnIIMn2III)O4 + 8Al = 9Mn
+ 4Al2O3 (700–900 °C)
Наиболее чистый марганец выделяют электролизом раствора из солей марганца(II), например:
![]()
Промышленно важен сплав с железом – ферромарганец (> 70 % Mn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) MnO2.
Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата MnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и H2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Уравнения важнейших реакций:
4MnO2 = 2Mn2O3 + O2 (530–585 °C)
2MnO2 + 2H2SO4 (конц.) = MnSO4 + O2↑ + 2Н2O (кипячение)
MnO2 + 4HCl (конц.) = MnCl2 + Cl2↑ + 2H2O
MnO2 + H2SO4 (гор.) + KNO2 = MnSO4 + KNO3 + H2O
MnO2 + 2H2SO4 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
MnO2 + 2KOH + KNO3 = K2MnO4 + KNO2 + H2O (350–450 °C)
3MnO2 + 3K2CO3 + KClO3 = 3K2MnO4 + KCl + 3CO2 (400 °C)
В природе самое распространенное соединение марганца – минерал пиролюзит.
Манганат калия К2MnO4.
Оксосоль. Темно‑зеленый, плавится под избыточным давлением O2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону MnO42‑. Медленно разлагается при разбавлении раствора водой, быстро – при подкислении. Проявляет окислительно‑восстановительные свойства.
Качественная реакция – появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:
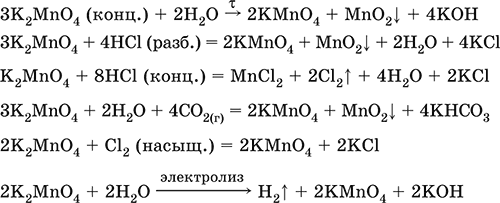
Получение: сплавление MnO2 с сильными окислителями (KNO3, КСlO3).
Пермапгапат калия КMnO4.
Оксосоль. Красно‑фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно‑фиолетовая
окраска раствора отвечает иону MnO4‑), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до MnII, в нейтральной среде – до MnIV, в сильнощелочной среде – до MnVI.
Качественная реакция на ион MnO4‑ – исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике.
Смотрите также
Реакция катализа и промышленные катализаторы
...
Реакции С и О ацилирования
Реакции ацилирования обладают очень многими полезными свойствами. Они
позволяют вести в молекулу функциональную группу C=O путем реакций присоединения либо замещения, не подвергая исходную
м ...
Химическое выветривание
Химическое выветривание
— это совокупность различных химических процессов, в результате которых
происходит дальнейшее разрушение горных пород и качественного изменения их
химического состава с обра ...


