Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
НатрийCправочник по химии для подготовки к ЕГЭ / Металлы главных подгрупп I–III групп / Cправочник по химии для подготовки к ЕГЭ / Металлы главных подгрупп I–III групп / Натрий НатрийСтраница 1
Натрий – элемент 3‑го периода и IA‑группы Периодической системы, порядковый номер 11. Электронная формула атома [10Ne]3s1, степени окисления +I и 0. Имеет малую электроотрицательность (0,93), проявляет только металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли натрия хорошо растворимы в воде. При намереньи сэкономить бюджет не во вред первоклассности совокупления, выбирайте самостоятельных индивидуалок на страничках интим сайта prostitutkivolgograda24.com. Здесь отобраны откровенные предложения девушек различных возрастов.
В природе – пятый
по химической распространенности элемент (второй среди металлов), встречается только в виде соединений. Жизненно важный элемент для всех организмов.
Натрий, катион натрия и его соединения окрашивают пламя газовой горелки в ярко‑желтый цвет (качественное обнаружение).
Натрий
Na. Серебристо‑белый металл, легкий, мягкий (режется ножом), низкоплавкий. Хранят натрий в керосине. С ртутью образует жидкий сплав – амальгаму (до 0,2 % Na).
Весьма реакционноспособный, во влажном воздухе натрий медленно покрывается гидроксидной пленкой и теряет блеск (тускнеет):
![]()
Натрий химически активен, сильный восстановитель. Воспламеняется на воздухе при умеренном нагревании (>250 °C), реагирует с неметаллами:
2Na + O2 = Na2O2 2Na + H2 = 2NaH
2Na + Cl2 = 2NaCl 2Na + S = Na2S
6Na + N2 = 2Na3N 2Na + 2C = Na2C2
Очень бурно и с большим экзо‑эффектом натрий реагирует с водой:
2Na + 2H2O = 2NaOH + Н2↑ + 368 кДж
От теплоты реакции кусочки натрия расплавляются в шарики, которые начинают беспорядочно двигаться из‑за выделения Н2. Реакция сопровождается резкими щелчками вследствие взрывов гремучего газа (Н2 + O2). Раствор окрашивается фенолфталеином в малиновый цвет (щелочная среда).
В ряду напряжений натрий стоит значительно левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород (за счет Н2O и Н+).
Получение натрия в промышленности:
![]()
(см. также ниже получение NaOH).
Натрий применяется для получения Na2O2, NaOH, NaH, а также в органическом синтезе. Расплавленный натрий служит теплоносителем в ядерных реакторах, а газообразный – используется как наполнитель желтосветных ламп наружного освещения.
Оксид натрия
Na2O. Основный оксид. Белый, имеет ионное строение (Na+)2O2‑. Термически устойчивый, при прокаливании медленно разлагается, плавится под избыточным давлением пара Na. Чувствителен к влаге и углекислому газу в воздухе. Энергично реагирует с водой (образуется сильнощелочной раствор), кислотами, кислотными и амфотерными оксидами, кислородом (под давлением). Применяется для синтеза солей натрия. Не образуется при сжигании натрия на воздухе.
Уравнения важнейших реакций:
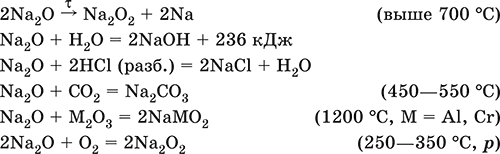
Получение: термическое разложение Na2O2 (см.), а также сплавление Na и NaOH, Na и Na2O2:
2Na + 2NaOH = 2NaaO + H2 (600 °C)
2Na + Na2O2 = 2NaaO (130–200 °C)
Пероксид натрия Na2O2
. Бинарное соединение. Белый, гигроскопичный. Имеет ионное строение (Na+)2O22‑. При нагревании разлагается, плавится под избыточным давлением O2. Поглощает углекислый газ из воздуха. Полностью разлагается водой, кислотами (выделение O2 при кипячении – качественная реакция на пероксиды). Сильный окислитель, слабый восстановитель. Применяется для регенерации кислорода в изолирующих дыхательных приборах (реакция с СO2), как компонент отбеливателей ткани и бумаги. Уравнения важнейших реакций:
Смотрите также
Фотоколориметрическое определение салициловой кислоты в фармпрепаратах
...
Синтез 4-бром-4’-гидроксибифенила
Настоящая работа посвящена синтезу 4-бром-4’-гидроксибифенила. Это
соединение является важным реагентом для синтеза ферроценсодержащих жидких
кристаллов. Введение в молекулу ферроцена бифени ...
Получение хлора и щелочи путем электролиза водных растворов хлоридов щелочных металлов. Извлечение ртути
Электролизеры для производства хлора и щелочи, в
которых используется ртутная амальгама, находят широкое применение благодаря
возможности получения концентрированных растворов щелочи. Однако ...


