Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Влияние ионной силы на скорость реакции.Статьи и работы по химии / Гомогенный катализ / Статьи и работы по химии / Гомогенный катализ / Влияние ионной силы на скорость реакции. Влияние ионной силы на скорость реакции.Страница 1
Во всех уравнениях химической кинетики фигурируют концентрации реагирующих веществ. В термодинамике же константа равновесия неидеальной системы выражается через активности. Это обстоятельство необходимо учитывать, если в кинетическое уравнение входит константа равновесия. Правда, при реакциях в газовой фазе и между нейтральными молекулами в растворе в этом нет практической необходимости, но при рассмотрении реакций между заряженными частицами подобное пренебрежение может явиться источником существенных ошибок. Для константы скорости бимолекулярной реакции
![]()
протекающей в растворе, теория активного комплекса дает
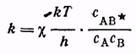
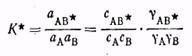 Термодинамическая же константа равновесия между исходными веществами и активным комплексом
Термодинамическая же константа равновесия между исходными веществами и активным комплексом
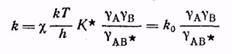 |
Комбинируя эти уравнения получаем уравнение Бренстеда-Бьеррума:
Для константы скорости реакции, протекающей в любой неидеальной среде. Величина k0 имеет смысл константы скорости при бесконечном разведении, т. е. при γ=1.
где А—постоянная, равная для водных растворов при 25° С примерно 0,51
z — заряд иона;
I — ионная сила раствора;
b — некоторая постоянная, примерно обратно пропорциональная радиусу иона.
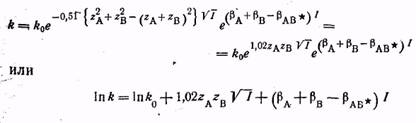 |
Рассмотрим два случая:
1. Взаимодействие между заряженными частицами.
Смотрите также
Обсуждение полученных результатов.
Исходя из результатов синтеза, можно сделать вывод о том, что:
- серная кислота является хорошим катализатором для данной реакции;
-поддерживаемая температура оказалась благоприятной для про ...
Химико-технологические системы производств кремния высокой чистоты
По распространенности в земной коре (27,6%)
кремний занимает второе место после кислорода. Металлический кремний и его
соединения (в виде силикатов, алюмосиликатов и др.) нашли применение в
...


