Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кинетические уравнения каталитических процессов.Статьи и работы по химии / Гомогенный катализ / Статьи и работы по химии / Гомогенный катализ / Кинетические уравнения каталитических процессов. Кинетические уравнения каталитических процессов.
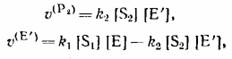 |
У четырех уравнений материального баланса, которые в замкнутой системе имеют вид:
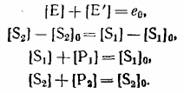 |
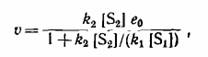 |
Т.е. первая стадия становится лимитирующей
Kм – сonst Михаэлиса, которая была впервые введена для реакций, катализируемых ферментами.
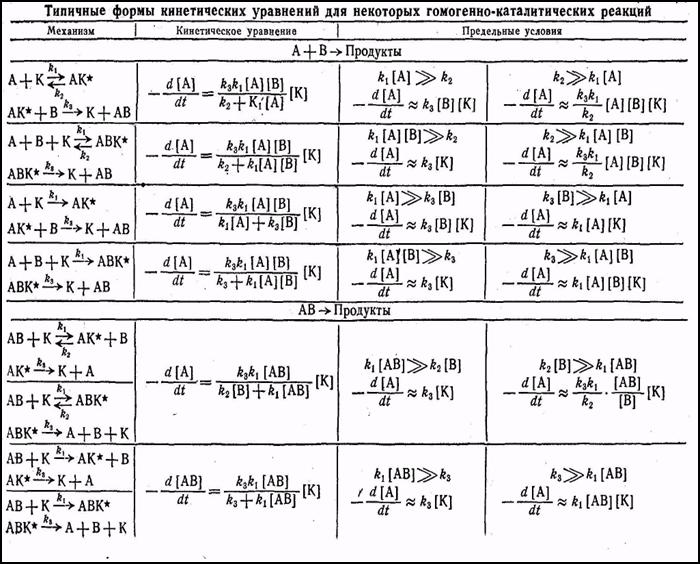 Уравнение Михаэлиса – широко используется прежде всего в реакциях, катализируемых ферментами, однако оно применимо к любой каталитической реакции, происходящей по механизму образования промежуточного комплекса катализатор-субстрат.
Уравнение Михаэлиса – широко используется прежде всего в реакциях, катализируемых ферментами, однако оно применимо к любой каталитической реакции, происходящей по механизму образования промежуточного комплекса катализатор-субстрат.
Смотрите также
Cульфоксидный комплекс гидрохинона как фотоинициатор полимеризации метилметакрилата
Рассматривается
поведение сульфоксидного комплекса гидрохинона в радикальной полимеризации
метилметакрилата. Показано, что в отличии от гидрохинона такой комплекс участвует
в фотоинициирова ...
Усовершенствование технологии установки висбрекинга
Нефть и газ– это основные источники
энергии в современном мире. На топливах, полученных из них, работают двигатели
сухопутного, воздушного и водного транспорта, тепловые электростанции. В
н ...
Проектирование производства фосфорсодержащего вещества
Фосфорсодержащие полимеры привлекают внимание многих исследователей своими ценными качествами и потенциальными возможностями. К ним, прежде всего, относятся: огнестойкость, хорошая адгезия к ряду ...


