Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гидролиз
солей многоосновных кислот и основанийСтатьи и работы по химии / Гидролиз солей. Особенности почвенного гидролиза / Статьи и работы по химии / Гидролиз солей. Особенности почвенного гидролиза / Гидролиз
солей многоосновных кислот и оснований Гидролиз
солей многоосновных кислот и основанийСтраница 1
Рассмотрим теперь гидролиз солей, образованных слабой многоосновной кислотой или слабым основанием многовалентного металла. Гидролиз таких солей протекает ступенчато. Так, первая ступень гидролиза карбоната натрия протекает согласно уравнению
Nа2СО
Nа2СО3 + Н2О ![]() NаНСО3 + NаОН, или в ионно-молекулярной форме:
NаНСО3 + NаОН, или в ионно-молекулярной форме:
![]()
![]() + Н2О
+ Н2О ![]() НСО3 - + ОН-.
НСО3 - + ОН-.
Образовавшаяся кислая соль в свою очередь подвергается гидролизу (вторая ступень гидролиза)
NаНСО3 + Н2О ![]() Nа2СО3 + NаОН, Или НСО3 - + Н2О
Nа2СО3 + NаОН, Или НСО3 - + Н2О ![]() Nа2СО3 + ОН-.
Nа2СО3 + ОН-.
Как видно, при гидролизе по первой ступени образуется ион НСО3-, диссоциация которого характеризуется второй константой диссоциации угольной кислоты
НСО3-![]() Н+ +
Н+ +![]() ;
;
К2, кисл. = 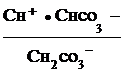
При гидролизе по второй ступени образуется угольная кислота, диссоциацию которой характеризует первая константа ее диссоциации
НСО3 ![]() Н+ +Н
Н+ +Н![]() ;
;
К1, кисл. = 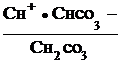 .
.
Поэтому константа гидролиза по первой ступени
Кг,1= 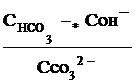
связана со второй константой диссоциации кислоты, в константа гидролиза по второй ступени
Кг,2= 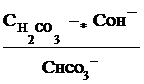
с первой константой диссоциации кислоты. Эта связь выражается соотношениями:
Кг,1= 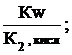 Кг,2=
Кг,2= 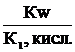 .
.
Поскольку первая константа диссоциации кислоты всегда больше второй, то константа гидролиза по первой ступени всегда больше, чем константа гидролиза по второй ступени: Кг,1> Кг,2. По этой причине гидролиз по первой ступени всегда протекает в большей степени, чем по второй. Кроме того, ионы, образующиеся при гидролизе по первой ступени (в нашем примере - ионы ОН -), способствуют смещению равновесия второй ступени влево, т.е. также подавляют гидролиз по второй ступени.
Аналогично происходит гидролиз солей, образованных слабым основанием многовалентного металла. Например, гидролиз CuCl2, который по первой ступени протекает с образованием гидроксохлорида меди
CuCl2 + Н2О ![]() CuОНCl +НСl или в ионно-молекулярной форме
CuОНCl +НСl или в ионно-молекулярной форме
Cu2+ + Н2О ![]() CuОН+ + Н+.
CuОН+ + Н+.
Гидролиз по второй ступени происходит в ничтожно малой степени:
CuОНCl+ + Н2О ![]() Cu (ОН) 2 + НСl Или CuОН+ + Н2О
Cu (ОН) 2 + НСl Или CuОН+ + Н2О ![]() Cu (ОН) 2 + Н.
Cu (ОН) 2 + Н.
Примером гидролиза солей многоосновных слабых кислот и слабых оснований может служить гидролиз ацетата алюминия, протекающий до основных солей - гидроксоацетата дигидроксоацетата алюминия:
Аl (СН3СОО) 3+ Н2О ![]() Аl (ОН) (СН3СОО) 2+ СН3СООН;
Аl (ОН) (СН3СОО) 2+ СН3СООН;
Аl (ОН) (СН3СОО) 2 + Н2О ![]() Аl (ОН) 2 (СН3СОО) + СН3СООН.
Аl (ОН) 2 (СН3СОО) + СН3СООН.
Рассмотрим для данного случая отдельно гидролиз катиона и гидролиз аниона. Эти процессы выражаются ионно-молекулярными уравнениями:
Смотрите также
Алюминий
АЛЮМИНИЙ (лат. Aluminium; от "alumen" —
квасцы), Al, химический элемент III группы периодической системы, атомный номер
13, атомная масса 26,98154.
...
Приготовление сорбентов и колонок для высокоэффективной жидкостной хроматографии
...
Производство экстракционной фосфорной кислоты
Фосфорная кислота является основным сырьем для
производства фосфорных удобрений, кормовых добавок, инсектицидов и других
фосфорсодержащих продуктов. Общее мировое потребление фосфатного сырь ...


