Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Рассмотрим частные случаи. Для определённости выделим пару
реагент-продукт:Статьи и работы по химии / Гетерогенный катализ / Статьи и работы по химии / Гетерогенный катализ / Рассмотрим частные случаи. Для определённости выделим пару
реагент-продукт: Рассмотрим частные случаи. Для определённости выделим пару
реагент-продукт:Страница 1
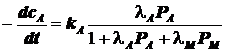 , где
, где 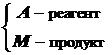 . (12.11)
. (12.11)
Основные случаи следующие:
1) Продукт M адсорбируется слабее реагента A:
![]()
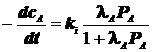
а) ![]()
![]() Наблюдаем:1-й порядок по реагенту A
Наблюдаем:1-й порядок по реагенту A
б) ![]()
![]() Наблюдаем: 0-й порядок по реагенту A
Наблюдаем: 0-й порядок по реагенту A
2) Реагент A адсорбируется слабее продукта, а продукт M адсорбируется очень сильно: ![]()
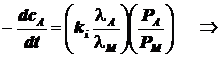 Продукт M тормозит реакцию.
Продукт M тормозит реакцию.
4.3) Приведём несколько различных вариантов протекания гетерогенного катализа в реакциях разложения соединений на металлических катализаторах. (см. А.В. Раковский, Курс физической химии, стр.510-511):
4.3.1. Слабая адсорбция. Молекулы покрывают лишь малую часть катализатора:
Так протекает разложение 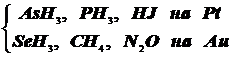 Порядок первый.
Порядок первый.
4.3.2. Средняя адсорбция реагирующего газа: Разложение ![]() . Порядок дробный - согласуется с уравнением адсорбции Бедекера- Фрейндлиха.
. Порядок дробный - согласуется с уравнением адсорбции Бедекера- Фрейндлиха.
4.3.3. Реагирующее вещество адсорбируется слабо, а продукт со средней силой:
![]()
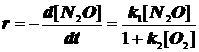
4.3.4. Реагирующий газ адсорбируется слабо, продукт сильно:
![]() на Pt :
на Pt : 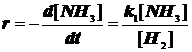
4.3.5. Реагирующий газ адсорбируется сильно:
![]() на W: нулевой порядок по аммиаку.
на W: нулевой порядок по аммиаку.
Рассмотрим классический пример – газофазную реакцию: H2+1/2O 2= H2O
Истинный механизм этой реакции состоит из многих стадий (до 30). Существуют различные подходы к его описанию. Выделим лишь некоторые наиболее характерные стадии, и введём очень упрощённую модельную схему, пригодную для классификации основных элементарных превращений, и с их помощью выделим главные особенности и выявим возможные режимы протекания всего процесса. Они возникают из-за конкуренции стадий разветвления и обрыва. Приводимый ниже механизм реализуется при невысоких давлениях (несколько десятков тор) (см. М.Н. Варгафтик, «Химическая кинетика» кафедральное пособие МИТХТ под ред. акад. Я.К. Сыркина, 1970, стр. 89, а также учебник «Физическая химия» под ред. К.С. Краснова, стр. 608). Основные стадии представим в нижеследующей таблице.
| Упрощённый механизм разветвлённой цепной реакции
H2+O2= H2O |
Баланс активных центров на отдельных стадиях |
Скорости элементарных стадий | |||||||
|
№ | Элементарные реакции |
Исх. |
Кон. | Скорость |
Природа стадии | ||||
|
1 |
H2 |
+ O2 ® |
2 HO· |
|
r1=k1[H2][O2] | Зарождение | |||
|
2 |
HO· |
+ H 2 ® |
H2O |
+ H· |
|
|
r2=k2[H 2][HO·] |
Продолжение | |
|
3 |
H· |
+ O 2 ® |
HO· |
+ O·· |
|
( · ·) |
r3=k3[O2][H·] |
Разветвление | |
|
4 |
O·· |
+ H2 ® |
HO· |
+ H· |
( · ·) |
|
r4=k4[H2][O··] | ||
|
5 |
H· |
+ O2 + M ® |
HO2 · |
+ M |
|
(·) |
r5=k5[M][O2][H·] |
квадрат. |
Обрыв |
|
6 |
H· |
+ M ® |
1/2 H2 |
+ M |
|
r6=k6[M][H·] |
линейн. | ||
Смотрите также
Свойства кальция
...
Исследование совместного электровосстановления гадолиния и
алюминия в галогенидных расплавах.
Из анализа
литературных данных следует, что процесс электровосстановления алюминия из
хлоридных и фторидных расплавов изучался в основном на платиновом электродах.
Электровосстановление
алюминия ...


