Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Коагуляция дисперсной системы. Скорость коагуляции. Причины,
вызывающие процесс самопроизвольной коагуляции.Статьи и работы по химии / Вычисление теплового эффекта реакций / Статьи и работы по химии / Вычисление теплового эффекта реакций / Коагуляция дисперсной системы. Скорость коагуляции. Причины,
вызывающие процесс самопроизвольной коагуляции. Коагуляция дисперсной системы. Скорость коагуляции. Причины,
вызывающие процесс самопроизвольной коагуляции.
Коагуляция – процесс самопроизвольного укрупнения (слипания) дисперсных частиц, который может происходить при действии на дисперсную систему различных факторов: при интенсивном перемешивании или встряхивании, нагреве или охлаждении, облучении светом или пропускании электрического тока, при добавлении к системе электролитов или неэлектролитов и др. При разных способах воздействия на систему происходит уменьшение энергии связи диспергированных частиц с окружающей их дисперсионной средой. Так, добавление электролита вызывает сжатие диффузного слоя в коллоидной частице, следовательно, понижение величины электрокинетического потенциала. Это приводит к уменьшению электростатического отталкивания коллоидных частиц и, как следствие, к большей вероятности их слипания.
Минимальная концентрация электролита, добавляемого к дисперсной системе, при которой наступает явная коагуляция за определенный промежуток времени, носит название порога коагуляции ![]() . Порог коагуляции определяется температурой, природой добавленного электролита, знаком заряда добавляемого иона (действует прежде всего ион, имеющий заряд, противоположный заряду коллоидных частиц) и величиной заряда этого иона. Так, для трех-, двух- и однозарядных ионов явная коагуляция наступает при концентрации электролитов в соотношении 1:10 - 50: 500-1000 (приближенное правило Шульце-Гарди).
. Порог коагуляции определяется температурой, природой добавленного электролита, знаком заряда добавляемого иона (действует прежде всего ион, имеющий заряд, противоположный заряду коллоидных частиц) и величиной заряда этого иона. Так, для трех-, двух- и однозарядных ионов явная коагуляция наступает при концентрации электролитов в соотношении 1:10 - 50: 500-1000 (приближенное правило Шульце-Гарди).
Порог коагуляции рассчитывается следующим образом:
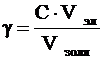 , (1)
, (1)
где g - порог коагуляции, кмоль/м3;
С – молярная концентрация раствора электролита, кмоль/м3;
Vэл – объем раствора электролита, м3;
Vзоля – объем золя, м3.
Теорию быстрой скорости коагуляции разработал Смолуховский. Он автор уравнения для расчета константы скорости коагуляции K:
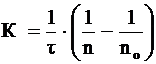 , (2)
, (2)
где n0 и n – число частиц в единице объема системы до начала коагуляции и к моменту времени ![]() соответственно;
соответственно;
t - время коагуляции, с.
Константа скорости коагуляции зависит от коэффициента диффузии для частиц и их радиуса следующим образом:
К = 8 · p · D · r. (3)
Учитывая уравнение (2) и уравнение Эйнштейна, окончательное уравнение для константы скорости коагуляции принимает вид:
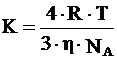 , (4)
, (4)
где К – константа скорости коагуляции, м3/с;
![]() – вязкость среды, Па·с;
– вязкость среды, Па·с;
NA – число Авогадро.
Смолуховский ввел также понятие о времени половинной коагуляции, согласно которому время, необходимое для уменьшения первоначального числа частиц в 2 раза, связано с их исходным числом следующим образом:
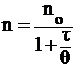 , (5)
, (5)
где q – время половинной коагуляции, с;
t – время от начала коагуляции, с.
Из уравнения, преобразованного к виду:
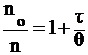 , (6)
, (6)
следует, что если построенный в координатах nо/n = f (t) график представляет собой прямую линию, то это служит показателем соответствия экспериментальных данных теории Смолуховского.
Смотрите также
Диэлектрические композиты на основе модифицированного субмикронного титаната бария и цианового эфира ПВС
Полимерно-неорганические композиты находят широкое
применение в различных областях техники благодаря сочетанию свойств полимера и
функционального наполнителя, что позволяет получать материал ...
Углеграфитовые материалы
Все виды
углеграфитовых материалов производятся на основе углерода. Ассортимент изделий
весьма многочислен, а каждый вид характеризуется оригинальными свойствами.
Основную роль в
создани ...
Замена углерода
Ученые немало
высказывались на тему возможности построения органических молекул с помощью
других атомов, но на практике доказать эту возможность на данный момент не
удалось.
...


