Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Билет №22.Статьи и работы по химии / Билеты по химии 10 класс / Статьи и работы по химии / Билеты по химии 10 класс / Билет №22. Билет №22.
Высшие кислородосодержащие кислоты химических элементов третьего периода, их состав и сравнительная характеристика свойств.
Фосфор образует целый ряд кислородсодержащих кислот (оксокислот). Некоторые из них мономерны. например фосфиновая, фосфористая и фосфорная(V) (ортофосфорная) кислоты. Кислоты фосфора могут быть одноосновными (однопротонными) либо многоосновными (многопротонными). Кроме того, фосфор образует еще полимерные оксокислоты. Такие кислоты могут иметь ациклическое либо циклическое строение. Например, дифосфорная(V) (пирофосфорная) кислота представляет собой димерную оксокислоту фосфора.
Наиболее важной из всех этих кислот является фосфорная(V) кислота (другое ее название - ортофосфорная кислота). При нормальных условиях она представляет собой белое кристаллическое вещество, расплывающееся при поглощении влаги из воздуха. Ее 85%-ный водный раствор называют «сиропообразной фосфорной кислотой». Фосфорнця(V) кислота является слабой трехосновной кислотой:
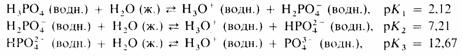
Хлор образует несколько кислородсодержащих кислот. Чем выше степень окисления хлора в этих кислотах, тем выше их термическая устойчивость и сила кислоты:
НОCl < НСlO2 < НСlO3 < НClO4
НClO3 и НClO4 – сильные кислоты, причем НСlO4 – одна из самых сильных среди всех известных кислот. Остальные две кислоты лишь частично диссоциируют в воде и существуют в водном растворе преимущественно в молекулярной форме. Среди кислородсодержащих кислот хлора только НСlO4 удается выделить в свободном виде. Остальные кислоты существуют только в растворе.
Окислительная способность кислородсодержащих кислот хлора уменьшается с возрастанием его степени окисления:
![]()
НОСl и НClO2 – особенно хорошие окислители. Например, кислый раствор НОCl:
1) окисляет ионы железа (II) до ионов железа (III):
![]()
2) на солнечном свету разлагается с образованием кислорода:
![]()
3) при нагревании приблизительно до 75 °С он диспропорционирует на хлорид-ионы и хлорат (V)-ионы:
![]()
Остальные высшие кислотсодержащие кислоты элементов третьего периода (H3AlO3, H2SiO3) более слабые, чем фосфорная кислота. Серная кислота (H2SO4) менее сильнае, чем хлорная (VII) кислота, но более сильная, чем фосфорная кислота. Вообще, при увеличении степени окисления элемента, образующего кислоту, увеличивается сила самой кислоты:
H3AlO3 < H2SiO3 < H3PO4 < H2SO4 < НСlO4
Смотрите также
Электролиз.
Цель работы - ознакомление
с процессами, протекающими на растворимых и нерастворимых электродах при
электролизе водных растворов электролитов.
Электролиз - это
окислительно-восстановительный ...
Разнообразие систем, формируемых дифильными веществами
...
Фтор
ФТОР (лат. Fluorum), F - химический элемент
VII группы периодической системы Менделеева, относится к галогенам, атомный номер 9, атомная масса 18,998403; при нормальных условиях (0 °С; 0,1 ...


