Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Билет №12 (углубленно).Статьи и работы по химии / Билеты по химии 10 класс / Статьи и работы по химии / Билеты по химии 10 класс / Билет №12 (углубленно). Билет №12 (углубленно).Страница 2
Для получения высокоактивных металлов (натрия, алюминия, магния, кальция и др.), легко вступающих во взаимодействие с водой, применяют электролиз расплава солей:
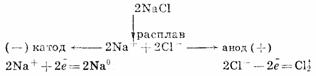
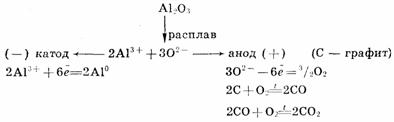
Зависимость количества вещества, образовавшегося под действием электрического тока, от времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фа-радея:
![]()
где m — масса образовавшегося при электролизе i-вещества (г); Э — эквивалентная масса i-вещества (г/моль); М — молярная масса i-вещества (г/моль); n — заряд i-иона; I — сила тока (A); t — продолжительность процесса; F — константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества (F = 96 500 К = 26,8 А•ч).
Смотрите также
Введение
Процессы ректификации являются одними из самых энергоемких
процессов химической технологии, и их эффективность часто определяет экономику
производства в целом. В ряде случаев на разделение методом р ...
Итоговый вид кинетического уравнения
В итоге получили
кинетическое уравнение, адекватно описывающее эксперимент:
Механизм реакции ...
Полимерные композиты на основе диальдегилцеллюлозы и полигуанилинметакрилата
Среди
полимеров, нашедших широкое применение в различных областях жизнедеятельности
человека, важное место занимает целлюлоза, как постоянно возобновляемый в
природе полимер, и ее производн ...


