Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Потенциометрическое титрование и обработка результатов.Библиотека / РН-метрия / Библиотека / РН-метрия / Потенциометрическое титрование и обработка результатов. Потенциометрическое титрование и обработка результатов.
Общие указания при потенциометрическом титровании применимы для большинства потенциометрических титрований, но в отдельных случаях можно вносить небольшие изменения.
1. Растворите пробу в 50 – 250 мл воды. Промойте электроды дистиллированной водой и погрузите их в анализируемый раствор. Приспособьте магнитную или механическую мешалку. Установите бюретку так, чтобы при добавлении реагента не происходило его разбрызгивания.
2. Подсоедините электроды к потенциометру, включите мешалку, измерьте и запишите начальный потенциал.
3. Измеряйте и записывайте потенциал после каждого добавления реагента. Сначала вводите реагент довольно большими порциями (0-5 мл). Не добавляйте следующую порцию, пока не установится практически постоянное значение потенциала (изменение не более 1-2 мВ или 0,05 единицы рН за 30 с). Иногда электродвигатель мешалки становится источником ошибочных значений потенциала; в таких случаях целесообразно выключать мешалку при измерении потенциала. Прикиньте, какой объем реагента надо добавить, и рассчитайте приблизительную величину ΔE/ΔV после каждого добавления. В непосредственной близости от точки эквивалентности вводите реагент порциями точно по 0,1 мл. После достижения точки эквивалентности добавьте еще 2 – 3 мл титранта. Как только ΔE/ΔV станет малым, вновь увеличьте объем добавляемого реагента.
4. Определите конечную точку одним из методов рассмотренных выше.
Проведем потенциометрическое титрование.
Два химических стакана объемом 100 мл ополоснем дистиллированной водой. После этого их ополоснем анализированным раствором серной кислоты. В подготовленные таким образом химические стаканы внесем при помощи мерного цилиндра или если стаканы мерные, то без помощи цилиндра 30 мл серной кислоты. После внесения кислоты мы имеем подготовленные растворы для потенциометрического анализа.
Подготовим рН-метр. Установим его на лабораторный стол, подготовим электроды. Как привило, для рН-метрии используют хлорсеребряный электрод. В цепи стеклянный электрод с водородной функцией будет индикаторным электродом, а хлорсеребряный – электродом сравнения. Хлорсеребряные электроды хранят опущенными в раствор соляной кислоты или дистиллированной воды. Стандартный потенциал стеклянного электрода зависит от сорта стекла и кроме того он изменяется со временем, поэтому рН растворов находят при помощи калибровальных графиков или используют калибровку прибора, что чаще. Для калибровки прибора используют дистиллированную воду, в которую опускают электроды и выставляют рН раствора равное 0, после этого прибор готов к работе.
Введем в химический стакан держатель с электродами от рН-метра. Установим бюретку со стандартизированным раствором NaOH 0,1 н. Установка для проведения анализов готова.
Для проведения анализа включаем рН-метр в сеть и устанавливаем переключатель в режим измерения рН. В химический стакан опускаем запаянный в стекло металлический стержень от магнитной мешалки, который предварительно ополоснули дистиллированной водой и исследуемым раствором кислоты и включаем магнитную мешалку на малые обороты. Подождем, пока не установится конечное значение рН среды. После чего можно начинать потенциометрическое титрование.
В первом анализе мы вводим раствор NaOH 0,1 н согласно поставленной задаче по 2 мл. ждем около 20 -30 секунд пока не установится окончательное значение рН среды и записываем его в таблицу 1.
Таблица 1. Данные предварительного титрирования.
|
V(NaOH), мл |
2,0 |
4,0 |
6,0 |
8,0 |
10,0 |
12.0 |
14,0 |
16,0 |
|
рН |
1,36 |
1,42 |
1,48 |
1,54 |
1,6 |
1,67 |
1,74 |
1,82 |
|
V(NaOH), мл |
18,0 |
20,0 |
22,0 |
24,0 |
26,0 |
28,0 |
30,0 |
32,0 |
|
рН |
1,9 |
2 |
2,11 |
2,26 |
2,45 |
2,76 |
7 |
11,51 |
|
V(NaOH), мл |
34,0 |
36,0 |
38,0 |
40,0 |
42,0 |
44,0 |
46,0 |
48,0 |
|
рН |
11,8 |
11,96 |
12,1 |
12,16 |
12,22 |
12,28 |
12,32 |
12,36 |
Во втором анализе проводим добавление порций щелочи NaOH также по 2 мл, но около точки эквивалентности порции уменьшаем до 0,2 мл с целью получения более точной информации о реакции. Полученные данные титрования заносим в таблицу 2.
Таблица 2. Данные окончательного титрирования.
|
V(NaOH), мл |
2,0 |
4,0 |
6,0 |
8,0 |
10,0 |
12.0 |
14,0 |
16,0 |
|
рН |
1,36 |
1,42 |
1,48 |
1,54 |
1,6 |
1,67 |
1,74 |
1,82 |
|
V(NaOH), мл |
18,0 |
20,0 |
22,0 |
24,0 |
26,0 |
28,0 |
28,2 |
28,4 |
|
рН |
1,90 |
2,0 |
2,11 |
2,26 |
2,45 |
2,76 |
2,81 |
2,86 |
|
V(NaOH), мл |
28.6 |
28,8 |
29,0 |
29,2 |
29,4 |
29,6 |
29,8 |
30,0 |
|
рН |
2,92 |
2,99 |
3,07 |
3,17 |
3,3 |
3,47 |
3,78 |
7 |
|
V(NaOH), мл |
30,2 |
30,4 |
30,6 |
30,8 |
31.0 |
31,2 |
31,4 |
31,6 |
|
рН |
10,52 |
10,82 |
11,0 |
11,12 |
11,22 |
11,30 |
11,36 |
11,42 |
|
V(NaOH), мл |
31,8 |
32,0 |
34,0 |
36,0 |
38,0 |
40,0 |
42,0 |
44,0 |
|
рН |
11,46 |
11,51 |
11,8 |
11,96 |
12,1 |
12,16 |
12,22 |
12,28 |
Полученные результаты анализа используем для построения кривых титрования и выявления точки эквивалентности и рН раствора в точке эквивалентности.
На рисунке 5.1 приведена кривая чернового титрования серной кислоты гидроксидом натрия. По кривой титрования мы можем оценить величину скачка титрования и вычислить необходимые концентрации.
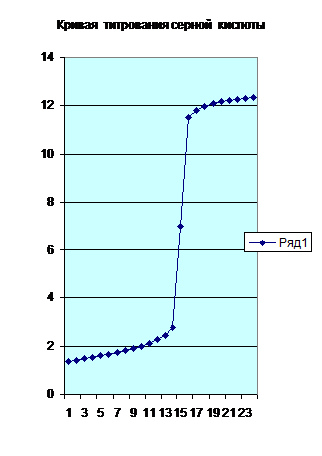
Рис. 5.1. Кривая чернового титрования 0.1 н. раствора серной кислоты 0.1 н. раствором гидроксида натрия.
Наведем также график более точного титрования раствора серной кислоты, когда около точки эквивалентности мы уменьшили дозы титранта до 0,2 мл. уменьшение дозы титранта около точки эквивалентности позволяет увеличить точность полученных данных и более точно построить кривую титрования. В общем случае около точки эквивалентности объемы добавляемого титранта составляют 0,1 – 0.05 мл.
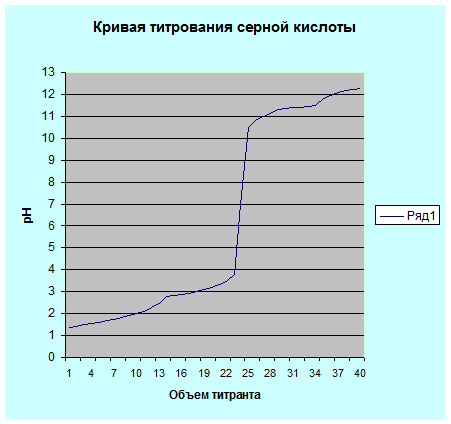
Рис. 5.2. Кривая титрования 0.1 н. раствора серной кислоты 0.1 н. раствором гидроксида натрия.
Рассмотрим рис. 5.2. по рисунку можно сделать вывод о точке эквивалентности.
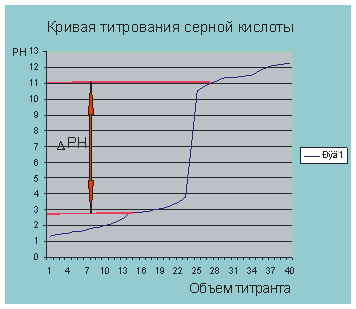
Рис. 5.3. кривая титрования о обозначение скачка титрования.
На рисунке 5.3. обозначен прыжок титрования. Поэтому
![]() .
.
При рН = 6.9 объем титранта равен по рисунку 5.2 30 мл. Мы практически провели потенциометрическое титрование раствора серной кислоты раствором щелочи.
Смотрите также
Расчет концентрации бензола в поглотительном масле. Определение расхода греющего пара
Абсорбер для
улавливания паров бензола из парогазовой смеси орошается поглотительным маслом
с мольной массой 260 кг/кмоль. среднее давление в абсорбере Рабс.=800
мм.рт.ст., температура 40°С ...


